CART 阻抑对阿尔茨海默病大鼠记忆能力的影响
刘 伟1) 常 娜1) 潘昊君1) 李 昕2) △
1) 河南大学淮河医院神经内科,河南 开封 475000 2) 郑州大学第二附属医院神经内科,河南 郑州 450014
基金项目:2014年河南省医学科技攻关计划重点项目,编号:201402018
△通信作者:李昕(1975-),研究生,副主任医师。 研究方向:脑血管病、神经变性病。 Email:lzh999@126.com
【摘要】 目的 探讨可卡因苯丙胺调节转录肽(CART)对阿尔茨海默病(AD)大鼠脑内β淀粉样蛋白(Aβ)生成和 Tau蛋白磷酸化的影响。方法 实验分为4组,依次为模型组(AD大鼠)、实验组(AD模型大鼠尾静脉注射 CART)、假手术组(用等量的PBS代替 Aβ1-40)、对照组(正常饲养)。 脑侧室注射 Aβ1-40 构建 AD 大鼠模型,Morris水迷宫检测各组大鼠逃避潜伏期和穿越平台次数,ELISA 法检测脑组织中 Aβ1-40 水平,RT-PCR 检测脑组织中胰岛素降解酶(IDE)、中性内肽酶(NEP)、低密度脂蛋白受体相关蛋白(LRP-1)水平,Westernblot检测脑组织中 Tau蛋白磷酸化、IDE、LRP-1、NEP、糖原合成激酶3β(GSK-3β)、p-GSK-3β水平。 结果 实验组大鼠逃避潜伏期明显低于模型组,而穿越平台次数明显高于模型组。 实验组大鼠 Aβ1-40 水平、Tau5水平、Tau磷酸化水平(TaupSp199/202、TaupT231)、GSK-3β、p-GSK-3β明显低于模型组,而IDE、LRP-1、NEP明显高于模型组。 结论 CART能够通过调节IDE、LRP-1、NEP 水平降低 AD 大鼠模型中 Aβ1-40 水平,能够通过调节 GSK-3β抑制 Tau蛋白磷酸化,进而改善AD大鼠的记忆能力。
【关键词】 阿尔茨海默病;β淀粉样蛋白;Tau蛋白;记忆能力;可卡因苯丙胺调节转录肽
【中图分类号】 R-332 【文献标识码】 A 【文章编号】 1673-5110(2017)24-0001-06
Effect of CART inhibition of memory ability of Alzheimer's disease rats
LIU Wei*,CHANG Na,PAN Haojun,LI Xin
*Department of Neurology,Huaihe Hospital Affiliated to Henan University,Kaifeng 475000,China
【Abstract】 Objective To investigate the effects of CART on the levels of Aβ and the phosphorylation of tau in the brain of AD rat.Methods Rats were divided into 4 groups,followed by model group (AD rats),experimental group (AD model rats tail vein injection of CART),sham operation group (with the same amount of PBS instead of Aβ1-40),and control group (normal feeding).We used brain ventricular injection of Aβ1-40 to establishment AD rats model,Morris water maze was used to test rats escape latency and the times of crossing the platform.We detected Aβ1-40 levels in brain tissue by ELISA method,IDE,NEP and LRP-1 in brain tissue by RT-PCR,and levels of phosphorylation of tau,IDE,LRP-1,NEP,GSK-3β,p-GSK-3β by Western blot.Results The escape latency of the experimental group was significantly lower than that of the model group,and the number of crossing the platform was significantly higher than that of the model group.The levels of Aβ1-40,Tau 5,phosphorylation of Tau(Tau pSp199/202,Tau pT231),GSK-3β,p-GSK-3β in the experimental group was significantly lower than that of model group,while IDE,LRP-1,NEP were significantly higher than the model group.Conclusion CART can reduce the level of Aβ1-40 in the AD rat model by regulating the levels of IDE,LRP-1 and NEP and can reduce the phosphorylation of tau protein by regulation of GSK-3β,ultimately improve the memory ability of AD rats.
【Key words】 AD;Aβ;Tau protein;Memory ability;CART
阿尔茨海默病(Alzheimer’sdisease,AD) 是一种中枢神经系统疾病,又称为老年痴呆,主要表现为记忆功能减退、语言能力缺失等认知障碍[1-2] 。 据统计,全球范围内约有2千万 AD 患者[3] 。 AD 的发病机制较为复杂,其特征性的病理变化为β淀粉样蛋白(β-amyloidprotein,Aβ) 沉积和 Tau蛋白异常磷酸化[4] 。胰岛素降解酶(insulin-degrading-enzyme,IDE)、中性内肽酶(neprilysin,NEP)是 Aβ降解酶,在 AD患者脑内水平下降[5-6] 。 低密度脂蛋白受体相
关蛋白(lowdensitylipoproteinreceptor,LRP-1) 能够转运 Aβ,参与 Aβ的清除过程[7] 。Tau蛋白异常磷酸化受糖原合成激酶3β (glycogen synthasekinase3β,GSK-3β)的调控[8] 。
可卡因苯丙胺调节转录肽(cocaine-andamphetamine-regulatedtranscript,CART)是一种内源性的神经肽[9]。有研究表明,CART 能够改善 Aβ对神经的毒性作用,减少突触损伤,改善 AD 小鼠的学习记忆能力[10-11]。CART 对 AD 大鼠脑组织中Aβ沉积和Tau蛋白磷酸化的作用尚未见相关报道。本研究中通过构建 AD 大鼠模型,探讨 CART 对AD大鼠的作用,以期为进一步研究 AD 的发病机制提供新思路。
1 材料与方法
1.1 材料
1.1.1 实验动物:100只 Wistar大鼠由河南大学实验动物中心提供,体质量260~300g。
1.1.2 主要仪器及试剂:Trizol裂解液购自于碧云天生物科技有限公司;Aβ1-40 购自于美国 Millipore;Aβ1-40 ELISA 检测试剂盒购自于北京方程生物科技有限公司;IDE 抗体、LRP-1 抗体、NEP 抗体、GSK-3β抗体、p-GSK-3β抗体、GAPDH 抗体均购自于美国 Cellsignaling;Tau-5 抗 体、Tau pSp199/202 抗 体、Tau pT231抗体均购自于美国BD;辣根过氧化物标记的二抗购自于美国Sigma;反转录试剂盒、BCA蛋白浓度检测试剂盒均购自于宝生物工程(大连)有限公司;酶标仪购自于美国Sigma。
1.2 方法
1.2.1 阿尔茨海默病大鼠模型构建及实验分组:取Wistar大鼠随机分为4组(每组25只),依次为对照组、假手术组、模型组和实验组。其中模型组和实验组大鼠按照以下方法构建 AD大鼠模型。方法为:在实验前12h内断水禁食,每千克大鼠体质量注射3mL 10%的水合氯醛麻醉大鼠。将大鼠固定在立体定位仪上。参照参考文献[12]方法沿着大鼠颅定的正中线小心切开皮肤,根据大鼠的脑立体定位图在脑侧室缓慢注射 10μg的 Aβ1-40(生理盐水稀释为 10mg/mL)。 注射完毕后,留针8min,以保证溶液充分弥散。 缝合皮肤时用庆大霉素点滴。 假手术组用等量的PBS(0.1 mol/L)溶液代替Aβ1-40。造模成功后,实验组大鼠用 CART 尾静脉注射16d,2.5μg/(d·kg) 的 CART。假手术组和模型组大鼠用等量的生理盐水代替 CART。对照组大鼠正常饲养。 剔除造模和静脉注射过程中死亡大鼠,为了保证每组数量一致,每组最后均选取20只,其中10只用于检测大鼠的记忆能力,另外10只解剖后取大鼠脑组织,用于1.2.3、1.2.4、1.2.5的检测。
1.2.2 大鼠记忆能力检测:大鼠记忆 能 力 检 测 用Morris水迷 宫 方 法 检 测, 水 迷 宫 为 高 60cm, 直 径150cm 的圆形水池。 将水迷宫划分为4个象限,每个象限正上方有摄像机。 实验开始时,在第三象限放入一个白色的塑料泡沫为平台,分别从4个象限的入水点把大鼠面向池壁的方向放在水池中,保持泳池中的水位在平台上1cm,水温维持在22 ℃。 记录大鼠找到平台的时间为逃避潜伏期 (超过 60s记 为 60s),实验持续4d,每天检测4次,每次间隔时间为20min,逃避潜伏期为最后平均值。5d后撤掉平台,将大鼠在第1象限正中点面朝池壁的方向放入水中,观察并记录大鼠在60s内穿过平台的次数。 所有大鼠在实验开始前1d分别进行2min的适应性训练。
1.2.3 大鼠脑组织中 Aβ1-40 水平检测:取 AD 大鼠的脑皮层及海马组织,用 Aβ1-40ELISA 检测试剂盒检测组织中 Aβ1-40 水平。步骤简述如下:将组织匀浆后,吸取上清液,加入到提前包被有 Aβ1-40 抗体的96孔酶标板中,充分孵育反应后,PBST 洗涤,加入辣根过氧化物标记的二抗充分结合后,酶 标 仪 检 测 450nm 和590nm 处的吸光度,计算 Aβ1-40 浓度。 以对照组为内参,分析其他各组中 Aβ1-40 水平。
1.2.4 RT-PCR 检测IDE、LRP-1、NEP 水平: 取100mg的大鼠脑皮层组织,加入1 mL 的 Trizol溶液,混合后,放在室温下裂解反应 5 min,加入氯仿(Trizol与氯仿比例为5:1),剧烈震荡15s,放在室温条件下静置3min,4 ℃,14000r/min离心10min,吸取上清液至 EP管中,加入500μL的异丙醇,上下颠倒20 次,静置10 min,4 ℃,14000rpm 离心 10min,弃上清液,用乙醇洗涤 2 次,晾干后,用 DEPC水溶解,保存在-80 ℃ 备用。 反转录试剂盒反转录合成cDNA,RT-PCR 试剂盒检测目的基因的表达水平。
IDE上游引物:5’-CAAACACTGTTTATGGACTG-3’
下游引物:5’-TGCTGAATTGAATGTGTACC-3’;
LRP-1上游引物:5’-TCTTGGTGCCTTTTGTGTGAC-3’ 下游引物:5’-CTCTTCCTCGTTTTTGCTCTC-3’;GAPDH上游引物:5’-GCCAAGGCTGTGGGCAAGGT-3’ 下游引物:5’-TCTCCAGGCGGCACGTCAGA-3’; NEP上游引物:5’-AAAGCTAAAGAAGAAAACAG-3’下游引物:5’-CAGTGCCAACAAACAAAT-3’。
1.2.5 Westernblot检测:Tau 蛋白磷酸化、IDE、NEP、LRP-1、GSK-3β、p-GSK-3β水平:取大鼠脑皮层组织,加入组织裂解液(组织与裂解液比例为1:10),放置于冰上裂解40min后,匀浆器匀浆,12000r/min离心20 min,吸取上清液至新的 EP 管中,按照 BCA 蛋白浓度检测试剂盒对蛋白样品定量检测。蛋白样品与 Loadingbuffer充分混合后,放在100 ℃加热5min,将变性蛋白样品加入到凝胶(8.5%分离胶,10% 浓 缩 胶)上样孔中,100 V 电压恒压电泳。120V,4 ℃转膜120 min,用5%脱脂奶粉放在室温下封闭60min,加入一抗(1000倍稀释,4 ℃ 孵育过夜)反应后,与辣根过氧化物标记的二抗(2000倍稀释,37 ℃ 孵 育 90 min)反应后,加入 ECL显色,以GAPDH 为内参,用ImageJ 分析目的蛋白的表达水平。
1.3 统计学处理 所得的实验数据均采用SPSS22.0统 计学软件分析,计量资料以均数 ± 标准差( x±s)表示,2组数据比较用t 检验,P <0.05为差异有统计学意义。
2 结果
2.1 大鼠记忆能力检测结果 构建的 AD 大鼠模型,经CART 连续处理16d后,水迷宫实验检测大鼠记忆能力。 结果发现,4d训练后,模型组大鼠逃避潜伏期明显高于对照组,差异具有统计学意义(P <0.01)。 假手术组大鼠逃避潜伏期与对照组大鼠相比差异无统计学意义(P >0.05)。 实验组大鼠逃避潜伏期明显 低 于 模 型 组,差 异 具 有 统 计 学 意 义 (P <0.01)。 如图1A。第5天去除平台后,模型组大鼠穿越平台次数明显低于对照组,差异具有统计学意义(P<0.01)。实验组大鼠穿越平台次数明显高于模型组,差异具有统计学意义(P<0.01)。 假手术组大鼠穿越平台次数与对照组相比差异无统计学意义(P>0.05)。 见图1B。
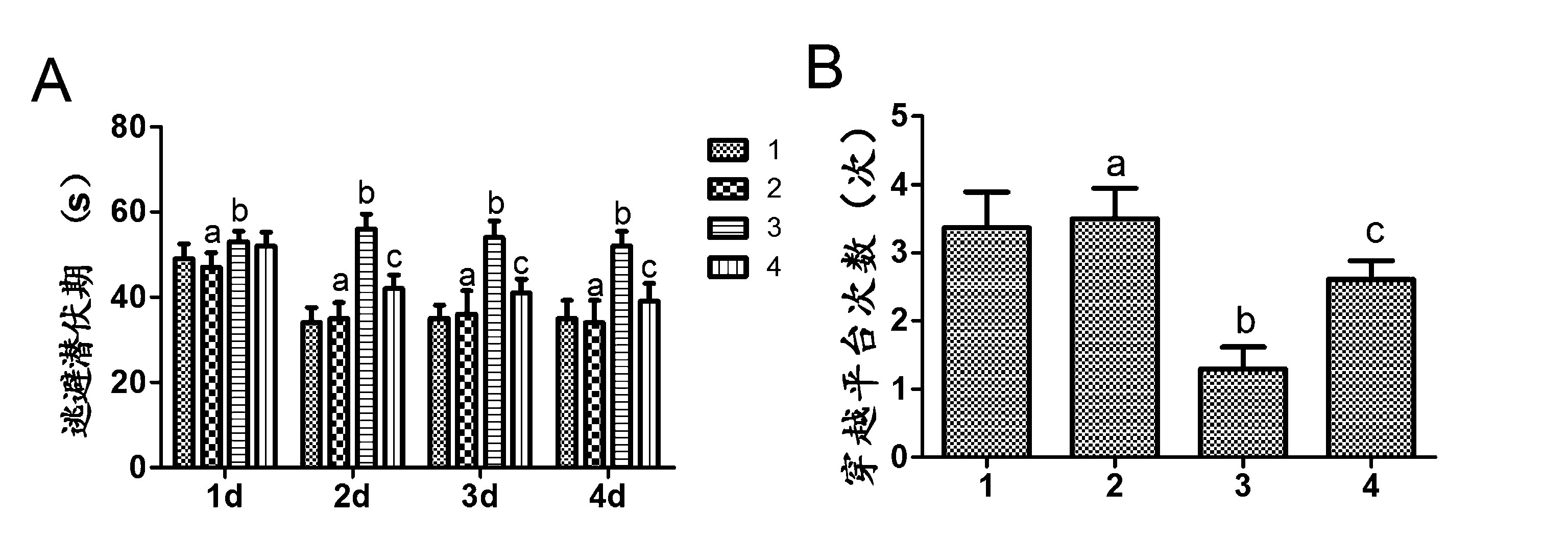
注:A:逃避潜伏期;B:目标象限停留时间;C:穿越平台次数;1:对照组;2:假手术组;3:模型组;4:实验组;aP>0.05 vs 1;bP<0.01 vs 1;cP<0.01 vs 3
图1 CART 对 AD大鼠记忆能力的影响
2.2 Aβ1-40 水平检测结果 大鼠经过16d的 CART处理后,取大鼠脑组织海马区 ELISA 检测Aβ1-40 水平。结果发现,模型组大鼠海马区组织匀浆液中的Aβ1-40 水平与对照组相比高出 3.7 倍。 假手术组大鼠海马区组织匀浆液中的 Aβ1-40 水平与对照组相比没有明显变化(P >0.05)。 实验组大鼠海马区组织匀浆液中的 Aβ1-40 水平较模型组相比下降了约59%。见图2。
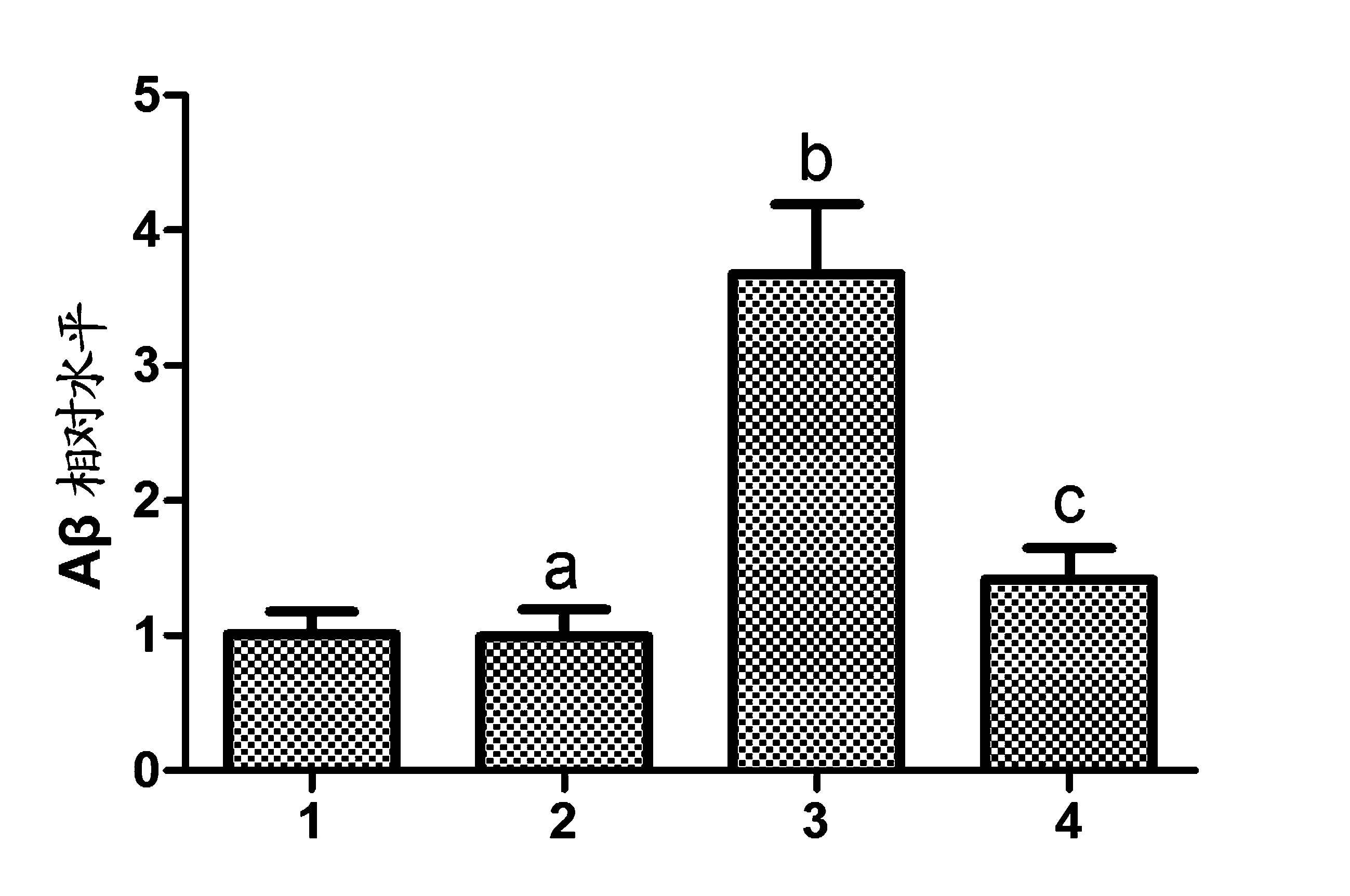
注:1:对照组;2:假手术组;3:模型组;4:实验组;aP>0.05 vs 1;bP<0.01 vs 1;cP<0.01 vs 3
图2 CART 对 AD大鼠脑组织中 Aβ1-40 水平的影响
2.3 IDE、NEP、LRP-1表达水平检测结果 检测各组大鼠脑组织中 Aβ代谢酶IDE、NEP、LRP-1表达水平。 RT-PCR 和 Westernblot结果均显示,模型组大鼠中IDE、NEP、LRP-1mRNA 和蛋白表达水平与对照组相比均明显降低,差异具有统计学意义(P <0.01)。实验组大鼠中IDE、NEP、LRP-1mRNA 和蛋白表达水平与模型组相比均明显升高,差异具有统计学意义(P<0.01)。见图3。
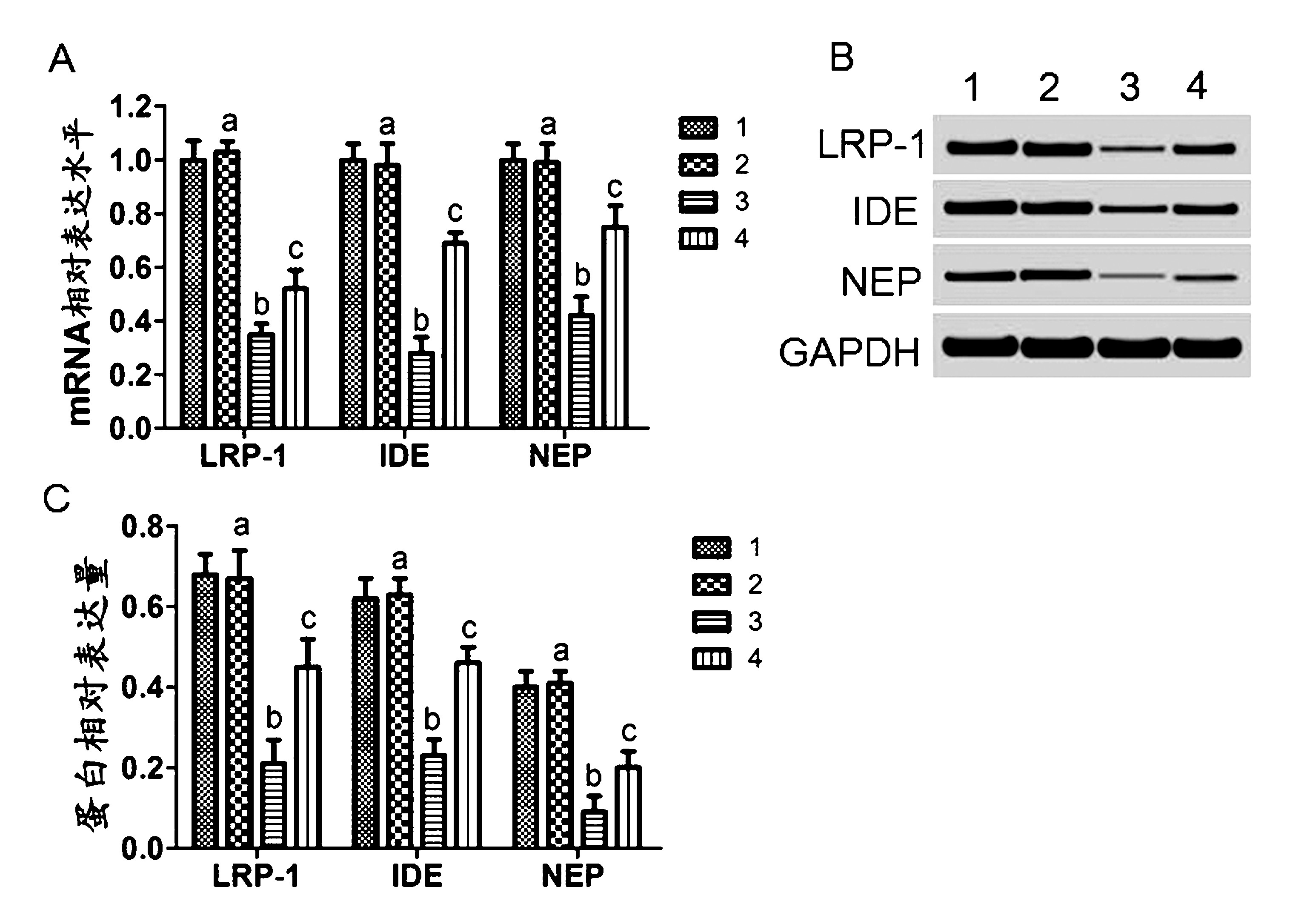
注:A:mRNA 相对表达水平;B:免疫印迹图;C:蛋白相对表达量;1:对照组;2:假手术组;3:模型组;4:实验组;aP>0.05 vs 1;bP<0.01 vs 1;cP<0.01 vs 3
图3 CART 对 AD大鼠脑组织中IDE、NEP、LRP-1表达水平的影响
2.4 Tau蛋白磷酸化水平检测结果 Tau5是磷酸化和非磷酸化的 Tau 蛋白抗体,检测 Tau5水平能够反映组织中 Tau蛋白的总体水平。模型组大鼠中Tau 5 水平及 Tau 磷酸化水平(Tau pSp199/202、Tau pT231) 明显高于对照组,差异具有统计学意义(P<0.01)。 实验组大鼠中 Tau5水平及 Tau 磷酸化水平(TaupSp199/202、Tau pT231) 明显低于模型组,差异具有统计学意义 (P <0.01)。 假手术组大鼠中Tau 5水平及Tau 磷酸化水平(Tau pSp199/202、Tau pT231)与对照组相比差异无统计学意义(P >0.05)。见图4。
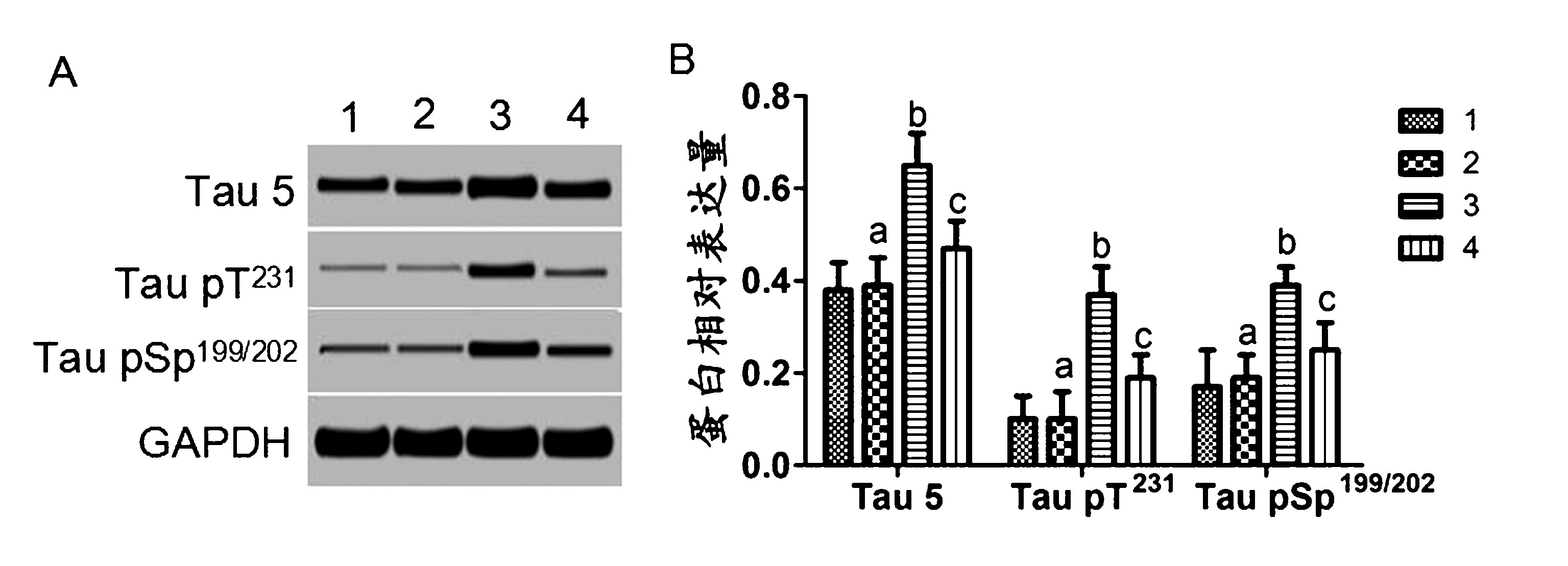
注:A:免疫印迹图;B:蛋白相对表达量;1:对照组;2:假手术组;3:模型组;4:实验组;aP >0.05 vs 1;bP<0.01 vs 1;cP<0.01 vs 3
图4 CART 对 AD大鼠脑组织中 Tau蛋白磷酸化水平影响结果
2.5 GSK-3β水平检测结果 GSK-3β是 Tau蛋白磷酸化过程中的重要调节酶。检测各组大鼠脑组织中 GSK-3β 水平发现,模型组大鼠中 GSK-3β、pGSK-3β水平均明显高于对照组,差异具有统计学意义(P<0.01)。实验组大鼠中 GSK-3β、p-GSK-3β水平均明显低于模型组,差异具有统计学意义(P <0.01)。假手术组大鼠中 GSK-3β、p-GSK-3β水平与对照组相比差异无统计学意义(P>0.05)。见图5。
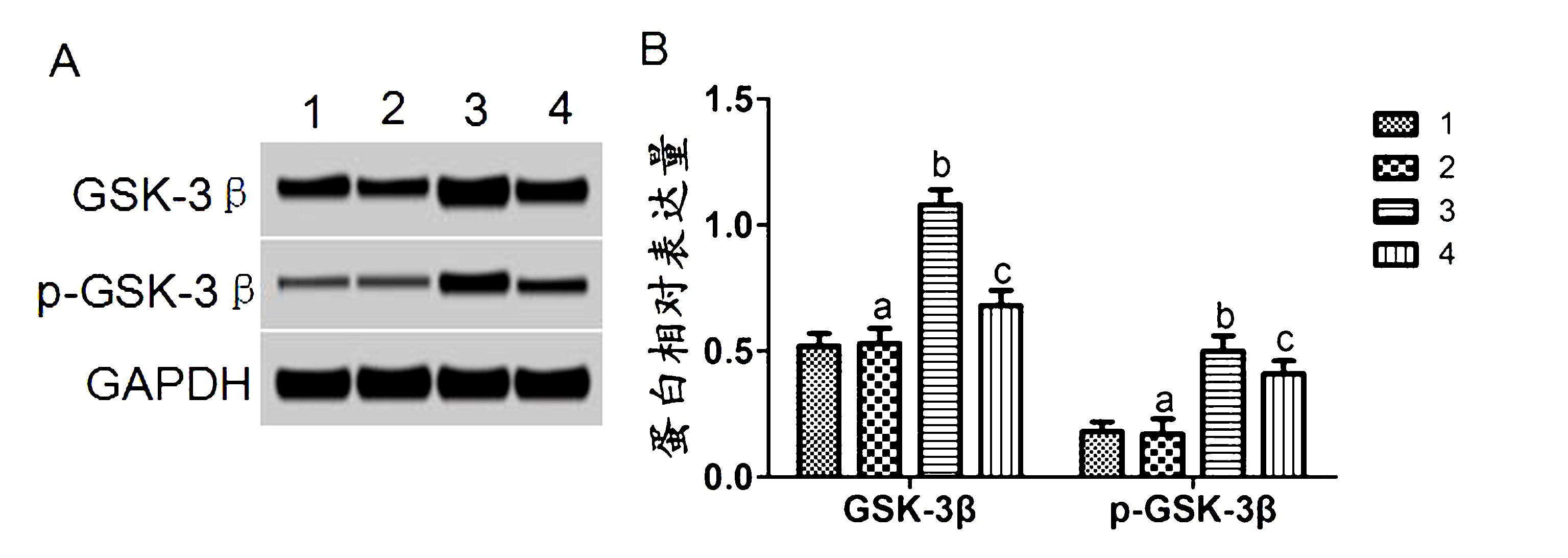
A:免疫印迹图;B:蛋白相对表达量;1:对照组;2:假手术组;3:模型组;4:实验组;aP>0.05vs1;bP<0.01vs1;cP<0.01vs3
图5 CART 对 AD大鼠脑组织中 GSK-3β水平的影响
3 讨论
随着我国人口的老龄化,AD 严重危害着人类的生命健康。研究 AD的发病机制是目前研究的重点。对于 AD的研究多集中于 AD 动物模型的构建。脑侧室给予 Aβ1-40 构建 AD 大鼠模型是目前较多的构建 AD大鼠模型的有效手段[13-14]。本研究中,通过脑侧室给予大鼠10μg的 Aβ1-40 成功构建了 AD 大鼠模型,经水迷宫实验检测,AD 模型大鼠记忆认知能力下降。 取各组大鼠的脑组织,检测发现,AD 模型大鼠 Aβ和 Tau蛋白磷酸化增多,这均提示成功构建了 AD大鼠模型。
Aβ沉积和 Tau蛋白磷酸化是 AD 典型的病理学特点。Aβ是由前体蛋白(amyloidprecursorprotein)水解而产生的,Aβ的异常沉积会导致组织和细胞生物学活性的异常,损害脑组织中的神经元,影响神经突触可塑性,进而导致学习记忆能力下降[15-17]。Tau蛋白的异常磷酸化能够导致神经元微管解体,导致神经元突起断裂。在 AD 患者脑内存在有 Aβ异常沉积和Tau蛋白异常磷酸化[18] 。Tau蛋白磷酸化有 21个位点,而Tau 蛋白在ser199/ser202(Tau pSp199/202)、thr231(TaupT231) 位点磷酸化在微管结合活性过程中发挥关键作用[19]。CART 能够有效改善Aβ导致的神经元细胞凋亡,并且能够改善 APP/PS1小鼠的记忆能力[20]。有研究表明[21-22],2.5μg 的CART能够改善 AD大鼠的记忆能力,减少脑组织中Aβ含量。IDE、LRP-1、NEP 参与 Aβ的代谢,在 AD患者中表达下调。 GSK-3β是 Tau蛋白磷酸化过程中的调控因子,在 AD患者中过度表达。
本研究中,脑侧室给予 AD 大鼠模型 CART 处理,水迷宫实验测定了大鼠的记忆能力。结果发现,CART 能够提高 AD 大鼠的记忆能力。而进一步检测脑组织中 Aβ沉积和 Tau蛋白磷酸化,结果发现,CART 减少 AD大鼠脑组织中 Aβ水平,提高 Aβ代谢相关酶IDE、LRP-1、NEP 的表达。Westernblot检测组织中 Tau蛋白和 Tau蛋白磷酸化水平,结果发现,CART 不仅能够降低 Tau蛋白的总体水平,而且对 Tau蛋白磷酸化也具有抑制作用。这提示,CART 能够通过调节 Tau蛋白磷酸化酶的水平影响Tau蛋白磷酸化水平,能够通过调控 Aβ代谢相关酶IDE、LRP-1、NEP的水平影响 Aβ含量。
CART 能够调控 AD 大鼠脑组织中 Aβ沉积和Tau蛋白磷酸化,进而提高 AD 大鼠模型的记忆能力。这为探讨 AD的发病机制奠定了基础,CART 对AD大鼠的作用机制还需要进一步深入研究。
4 参考文献
[1] PIN N.Cognitive Health of Older Persons in Longitu-dinal Ageing Cohort Studies[J].Sains Malaysiana,2016,45(9):1 351-1 355.
[2] Landau SM,Horng A,Fero A,et al.Amyloid negativity in patients with clinically diagnosed Alzheimer disease and MCI[J].Neurology,2016,86(15):1 377-1 385.
[3] Mormino EC,Sperling RA,Holmes AJ,et al.Polygenic risk of Alzheimer disease is associated with early-and late-life processes[J].Neurology,2016,87(5):481-488.
[4] FAKHRUDDIN N,Shahar S,AZIZ N A A B D.Which Aging Group Prone to Have Inadequate Nutrient Intake?:Tau Study[J].Sains Malaysiana,2016,45(9):1 381-1 391.
[5] Marples B,McGee M,Callan S,et al.Cranial irradiation significantly reduces beta amyloid plaques in the brain and improves cognition in a murine model of Alzheimer’s Disease (AD)[J].Radiotherapy and Oncology,2016,118(1):43-51.
[6] Mattsson N,Insel PS,Palmqvist S,et al.Cerebrospinal fluid tau,neurogranin,and neurofilament light in Alzheimer's disease[J].EMBO Molecular Medicine,2016,8(10): 1 184-1 196.
[7] Tarasoff-Conway JM,Carare RO,Osorio RS,et al.Clearance systems in the brain [mdash]implications for Alzheimer disease[J].Nature Reviews Neurology,2015,11(8):457-470.
[8] Fukunaga K,Sakai D,Watanabe K,et al.Discovery of novel 2-(alkylmorpholin-4-yl)-6-(3-fluoropyridin-4-yl)-pyrimidin-4 (3H)-ones as orally-active GSK-3β inhibitors for Alzheimer’s disease[J].Bioorganic & medicinal chemistry letters,2015,25(5):1 086-1 091.
[9] 朱万龙.下丘脑神经肽(NPY,AgRP,POMC,CART) 在大绒鼠体重和能量代谢中调节作用的研究[D].南京师范大学,2015.
[10] Emsen B,Aslan A,Togar B,et al.In vitro antitumor activities of the lichen compounds olivetoric,physodic and psoromic acid in rat neuron and glioblastoma cells[J].Pharm Biol,2016,54(9):1 748-1 762.
[11] Upadhya MA,Shelkar GP,Subhedar NK,et al.CART modulates the effects of levodopa in rat model of Parkinson’s disease[J].Behavioural brain research,2016,301(15):262-272.
[12] 李源,刘颖,袁海峰,等.人参皂苷 Rg1 对阿尔茨海默病模型大鼠脑片磷酸化 Tau 蛋白及胆碱乙酰基转移酶表达的影响[J].中国老年学杂志,2015,35(6):1 640 -1 641.
[13] Roche J,Shen Y,Lee JH,et al.Monomeric Aβ1-40 and Aβ1-42 Peptides in Solution Adopt Very Similar Rama-chandran Map Distributions That Closely Resemble Random Coil[J].Biochemistry,2016,55(5):762-775.
[14] Lin N,Xiong LL,Zhang R,et al.Injection of Aβ1-40 into hippocampus induced cognitive lesion associated with neuronal apoptosis and multiple gene expressions in the tree shrew[J].Apoptosis,2016,21(5):621-640.
[15] Chen P,Yan Q,Wang S,et al.Transfer of three transcription factors via a lentiviral vector ameliorates spatial learning and memory impairment in a mouse model of Alzheimer's disease[J].Gene,2016,587(1):59-63.
[16] Zumkehr J,Rodriguez-Ortiz CJ,Cheng D,et al.Ceftriaxone ameliorates tau pathology and cognitive decline via restoration of glial glutamate transporter in a mouse model of Alzheimer's disease[J].Neurobiology of aging,2015,36(7):2 260-2 271.
[17] Takeda S,Commins C,DeVos SL,et al.Seed-compe-tent high-molecular-weight tau species accumulates in the cerebrospinal fluid of Alzheimer's disease mouse model and human patients[J].Annals of Neurology,2016,80(3):355-367.
[18] Campbell SN,Zhang C,Roe AD,et al.Impact of CRFR1 Ablation on Amyloid-β Production and Accumulation in a Mouse Model of Alzheimer's Disease[J].Journal of Alzheimer's Disease,2015,45(4):1 175-1 184.
[19] Castillo-Carranza DL,Guerrero-Muñoz MJ,Sengupta U,et al.Tau immunotherapy modulates both pathological tau and upstream amyloid pathology in an Alzheimer's disease mouse model[J].The Journal of Neuroscience,2015,35(12):4 857-4 868.
[20] 金佳丽.CART 改善APP/PS1小鼠认知功能及其机制研究[D].南京大学,2013.
[21] 殷凯林.CART 通过调节 MAPK和 AKT 通路抑制 β 淀粉样蛋白沉积改善阿尔茨海默病认知功能的相关研究[D].南京大学,2014.
[22] Huang T,Meng N,Xu L,et al.Resveratrol promotes hUC-MSCs engraftment and neural repair in a mouse model of Alzheimer's disease[J].Behavioural brain research,2018,339:297-304.NIHMSID:NIHMS922220
(收稿2017-08-11)
本文编辑:王喜梅
引用信息:刘伟,常娜,潘昊君,等.CART阻抑对阿尔茨海默病大鼠记忆能力的影响[J].中国实用神经疾病杂志,2017,20(24):1-6.