趋化因子CC配基2对α-Synuclein诱导的小胶质细胞增殖及神经元凋亡的影响
张黎军 赵盼盼 赵建华 王超伟 李 青 随瑞斌 袁 彬△
新乡医学院第一附属医院神经内科,河南 新乡 453100
doi:10.3969/j.issn.1673-5110.2017.24.002
基金项目:河南省科技厅科技攻关项目,编号:172102310685
△通信作者:袁彬(1972—),博士,主任医师。研究方向:脑血管病基础与临床。Email:smith20081558@163.com
【摘要】 目的 探讨趋化因子CC配基2(CCL2)对α-突触核蛋白(α-Synuclein)介导的小胶质细胞增殖及神经元凋亡的影响。方法 体外分离培养原代小胶质细胞和原代神经元。小胶质细胞分为4组,依次为对照组、CCL2组、α-Synuclein组、CCL2+α-Synuclein组。对照组中加入等量的PBS,CCL2组细胞中加入含有CCL2浓度为0.05 ng/μL的培养液。α-Synuclein组细胞中加入含有α-Synuclein浓度为0.2 ng/μL的培养液。CCL2+α-Synuclein组中加入含有0.05 ng/μL CCL2、0.2 ng/μL α-Synuclein的细胞培养液。培养24 h后,检测小胶质细胞增殖情况及细胞中α-Synuclein蛋白水平,同时检测细胞培养液中TNF-α、IL-1β、NO含量。用各组小胶质细胞培养液培养原代神经元,观察神经元凋亡情况及神经元中Cleaved Caspase-3、Akt、p-Akt水平。结果 CCL2组、α-Synuclein组、CCL2+α-Synuclein组小胶质细胞增殖活性及分泌TNF-α、IL-1β、NO水平明显高于对照组(P<0.05)。CCL2组、CCL2+α-Synuclein组小胶质细胞中α-Synuclein水平明显高于对照组(P<0.01)。CCL2组、α-Synuclein组、CCL2+α-Synuclein组小胶质细胞培养液作用后的神经元凋亡率及Cleaved Caspase-3蛋白水平明显高于对照组,p-Akt水平低于对照组(P<0.01)。结论 CCL2促进α-Synuclein引起的小胶质细胞增殖和分泌TNF-α、IL-1β、NO的能力,对α-Synuclein引起的神经元凋亡也具有促进作用,促凋亡作用机制可能与Akt信号通路有关。
【关键词】 小胶质细胞;神经元;CCL2;凋亡;信号通路;小鼠
【中图分类号】 R-332 【文献标识码】 A 【文章编号】 1673-5110(2017)24-0007-06
Study on the effect of CCL2 on the proliferation of microglia and apoptosis of Neuron induced by α-Synuclein
ZHANG Lijun,ZHAO Panpan,ZHAO Jianhua,WANG Chaowei,LI Qing,SUI Ruibin,YUAN Bin
Department of Neurology,Xinxiang Medical College,Xinxiang 453100,China
【Abstract】 Objective To investigate the effects of CCL2 on the proliferation of microglia and apoptosis of Neuron induced by α-Synuclein.Methods Primary microglia and primary neurons were isolated and cultured in vitro.The microglia were divided into 4 groups,which were the control group,the CCL2 group,the α-Synuclein group,the CCL2+ α-Synuclein group.In the control group,the amount of PBS was added,and the cells in the CCL2 group were added with the culture solution containing 0.05ng/μL concentration of CCL2.α-Synuclein group cells were added to culture medium containing a 0.2ng/μL concentration of α-Synuclein.CCL2+ α-Synuclein group were added with CCL2 0.05ng/μL,0.2ng/μL α-Synuclein.After 24h culture,the proliferation of microglia and the level of α -Synuclein,the contents of TNF-α,IL-1β and NO in cell culture medium were detected.The primary neurons were cultured with cell culture medium in each group,the neuron apoptosis was observed and the levels of Cleaved Caspase-3 Akt,p-Akt and were observed.Results The proliferation activity and secretion of TNF-α,IL-1β,NO in the CCL2 group,the α-Synuclein group,the CCL2+ α-Synuclein group were significantly higher than that in control group (P<0.05).The level of α-Synuclein in CCL2 group and CCL2+ α-Synuclein group was significantly higher than that in control group (P<0.01).The apoptosis rate and Cleaved Caspase-3 protein level of CCL2 group,α-Synuclein group and CCL2+ α-Synuclein group were significantly higher than those in control group,the level of p-Akt was lower than that of control group (P<0.01).Conclusion CCL2 promotes the proliferation of the microglia and secretion of TNF-α,IL-1β,NO induced by α-Synuclein,and can promotes the apoptosis of neuron,the mechanism may be related to Akt signaling pathway.
【Key words】 Microglia;Neuron;CCL2;Apoptosis;Signal pathway;Rat
小胶质细胞是中枢神经系统中的重要免疫防线,是神经胶质细胞的成员之一,在脑组织和脊髓中的作用类似于巨噬细胞[1]。脑组织中神经胶质细胞中有20%为小胶质细胞[2]。阿尔兹海默病、帕金森病等疾病中都存在小胶质细胞的过度增殖活化,而小胶质细胞的过度活化会引发神经毒性[3]。趋化因子CC配基2是趋化因子家族成员之一,由人血管内皮细胞、星形胶质细胞、小胶质细胞、平滑肌细胞等多种细胞分泌,具有调控巨噬细胞趋化、激活嗜碱性粒细胞、参与细胞增殖凋亡过程等作用[4-5]。α-Synuclein是一种广泛存在于脑组织中的神经蛋白,在维持突触功能中发挥重要作用[6]。α-Synuclein的过度聚集会导致路易小体功能障碍,引发学习记忆等功能缺失[7]。有研究表明,CCL2能够促进小胶质细胞的增殖,促进炎症因子分泌,进而导致α-Synuclein的过度聚集产生毒性[8]。本研究以小胶质细胞为研究对象,探讨CCL2在α-Synuclein介导的小胶质细胞增殖和神经元凋亡中的作用,以期为治疗神经系统疾病提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物:出生24 h以内的SPF C57/BL6小鼠购自于新乡医学院动物实验中心。
1.1.2 主要仪器及试剂:DMEM/F12培养基、胰蛋白酶均购自于美国Sigma;胎牛血清(FBS)购自于美国 Gibco;双抗购自于北京鼎国生物技术有限公司;HERAcell 150i CO2培养箱、MK3酶标仪均购自于美国Thermo;α-Synuclein单克隆抗体、Cleaved Caspase-3单克隆抗体、Akt单克隆抗体、p-Akt单克隆抗体均购自于美国R&D;BCA Protein Quantification Kit购自于上海翊圣生物科技有限公司;TNF-α、IL-1β检测试剂盒购自于上海百蕊生物科技有限公司;NO含量检测试剂盒购自于北京普利莱(APPLYGEN)基因技术有限责任公司。
1.2 方法
1.2.1 小胶质细胞和神经元原代分离培养:参照参考文献[9]取出生24 h以内的小鼠(小鼠数量根据每次试验需求数量不同),用75%酒精消毒后,取出脑组织,将血管剥离,放在DMEM/F12培养基中,剪碎后,加入0.125%的胰蛋白酶10 mL,放在37 ℃的水浴锅中震荡消化反应5 min,加入胎牛血清终止消化,放在室温下静置3 min,观察组织沉淀到下层,吸取上清液至EP管中,过70 μm的网筛,滤液经1 000 rpm离心10 min后,弃掉上清液,加入含有15% FBS,100 U/mL双抗的DMEM/F12细胞培养液,种植到用赖氨酸提前包被的细胞培养瓶中,放在37 ℃,5% CO2培养箱中培养24 h后,更换细胞培养液。培养10 d后,小胶质细胞位于上层,下层细胞为神经元。取细胞瓶震荡培养60 min,吸除培养基,加入PBS洗涤细胞后,收集洗涤下来的细胞,接种到6孔细胞培养板中,每孔中加入3×105个细胞,培养30 min后,贴壁细胞为小胶质细胞,培养5 d后,可以收集原代小胶质细胞。
1.2.2 实验分组:细胞实验分为3组,依次为对照组、CCL2组、α-Synuclein组和CCL2+α-Synuclein组。对照组中加入等量的PBS,CCL2组细胞中加入含有CCL2浓度为0.05 ng/μL的培养液。α-Synuclein组细胞中加入含有α-Synuclein浓度为0.2 ng/μL的培养液。CCL2+α-Synuclein组中加入含有0.05 ng/μL CCL2、0.2 ng/μL α-Synuclein的细胞培养液。
1.2.3 MTT检测细胞增殖:将震荡后洗涤下来的细胞接种到96孔细胞培养板中,每孔中加入100 μL的细胞悬浮液,贴壁后,放在37 ℃,5% CO2培养箱中培养24 h。按照1.2.2实验分组更换细胞培养液培养24 h后,在每孔中加入20 μL的MTT溶液(5 mg/mL),放在 CO2培养箱中孵育4 h,加入150 μL的DMSO溶液,震荡反应10 min后,酶标仪检测450 nm每孔的吸光度。
1.2.4 Griess法检测NO含量:NO在水中可以生成NO2-,而在酸性环境中,NO2-能够与重氮盐磺胺生成重氮化合物,并与萘基乙烯二胺偶合。反应生成的化合物越多在540 nm处的吸光度越多,吸光度越高则NO含量越高。取各组细胞,按照1.2.2实验分组培养细胞24 h。按照NO含量检测试剂盒说明书检测细胞培养液中NO含量。
1.2.5 ELISA法检测TNF-α、IL-1β含量:取各组细胞,按照1.2.2实验分组培养细胞24 h。收集细胞培养液,按照ELISA检测试剂盒说明书检测细胞培养液中炎性因子水平。酶标仪检测450 nm处的每孔的吸光度。
1.2.6 Western blot检测细胞中α-Synuclein水平:取各组细胞,按照1.2.2实验分组培养细胞24 h后,弃培养液,加入细胞裂解液,放在冰上裂解30 min,混匀后,转移裂解液至离心管中,4 ℃,12 000 r/min离心10 min,吸取上清液至EP管中,利用 BCA Protein Quantification Kit检测提取的蛋白浓度。将蛋白样品与Loading buffer混合后,放在100 ℃煮沸5 min。将变性蛋白样品加入到SDS-PAGE凝胶上样孔中,每孔加入50 μL样品,电泳初始电压为90 V,观察溴酚蓝进入分离胶和浓缩胶边缘时,调整电压为120 V至电泳结束。取出蛋白凝胶,在4 ℃,转膜90 min。取出转膜后的PVDF膜,在5% 脱脂奶粉中37 ℃封闭90 min,依次与一抗(500倍稀释,4 ℃孵育过夜)、二抗(1 000倍稀释,37 ℃孵育90 min)反应后,滴加显色液,以GAPDH为内参,分析蛋白表达水平。
1.2.7 原代神经元培养:原代神经元培养方法参照1.2.1中小胶质细胞分离培养方法,过筛后,滤液经离心后,用含有10% FBS、2% B27、100 U/mL双抗的DMEM/F12细胞培养液悬浮细胞,接种至赖氨酸包被的细胞瓶中,24 h后更换为不含有胎牛血清的细胞培养培养细胞。分离培养后3 d即可获得原代神经元。
1.2.8 流式细胞仪检测凋亡:取各组细胞,按照1.2.2实验分组培养小胶质细胞24 h。吸取细胞培养液,加入到神经元中培养24 h,弃培养液,加入0.125%的胰蛋白酶消化后,1 500 r/min离心5 min,弃上清液,加入PBS洗涤一次,加Binding buffer悬浮混匀,调整浓度为3×106个/mL,每100 μL的悬浮液中加入5 μL的 Annexin V和PI,放在室温条件下反应10 min,流式细胞仪检测凋亡情况。
1.2.9.Western blot检测神经元中Cleaved Caspase-3、Akt、p-Akt水平:取各组细胞,按照1.2.2实验分组培养小胶质细胞24 h。吸取细胞培养液,加入到神经元中培养24 h,弃培养液,收集神经元蛋白,Western blot检测神经元中Cleaved Caspase-3、Akt、p-Akt水平,步骤同1.2.6。
1.3 统计学处理 采用SPSS 22.0统计学软件分析,计量资料以均数±标准差(x±s)表示,数据比较采用t检验,多组数据以上用单因素方差表示,以P<0.05,P<0.01为差异有统计学意义。
2 结果
2.1 细胞增殖检测结果 分离培养的小胶质细胞经CCL2、α-Synuclein、CCL2+α-Synuclein作用后,MTT检测细胞增殖情况。结果显示,α-Synuclein组细胞增殖能力显著高于对照组,差异显著(P<0.05)。CCL2组和CCL2+α-Synuclein组细胞增殖能力明显高于对照组,差异显著(P<0.01)。见图1。
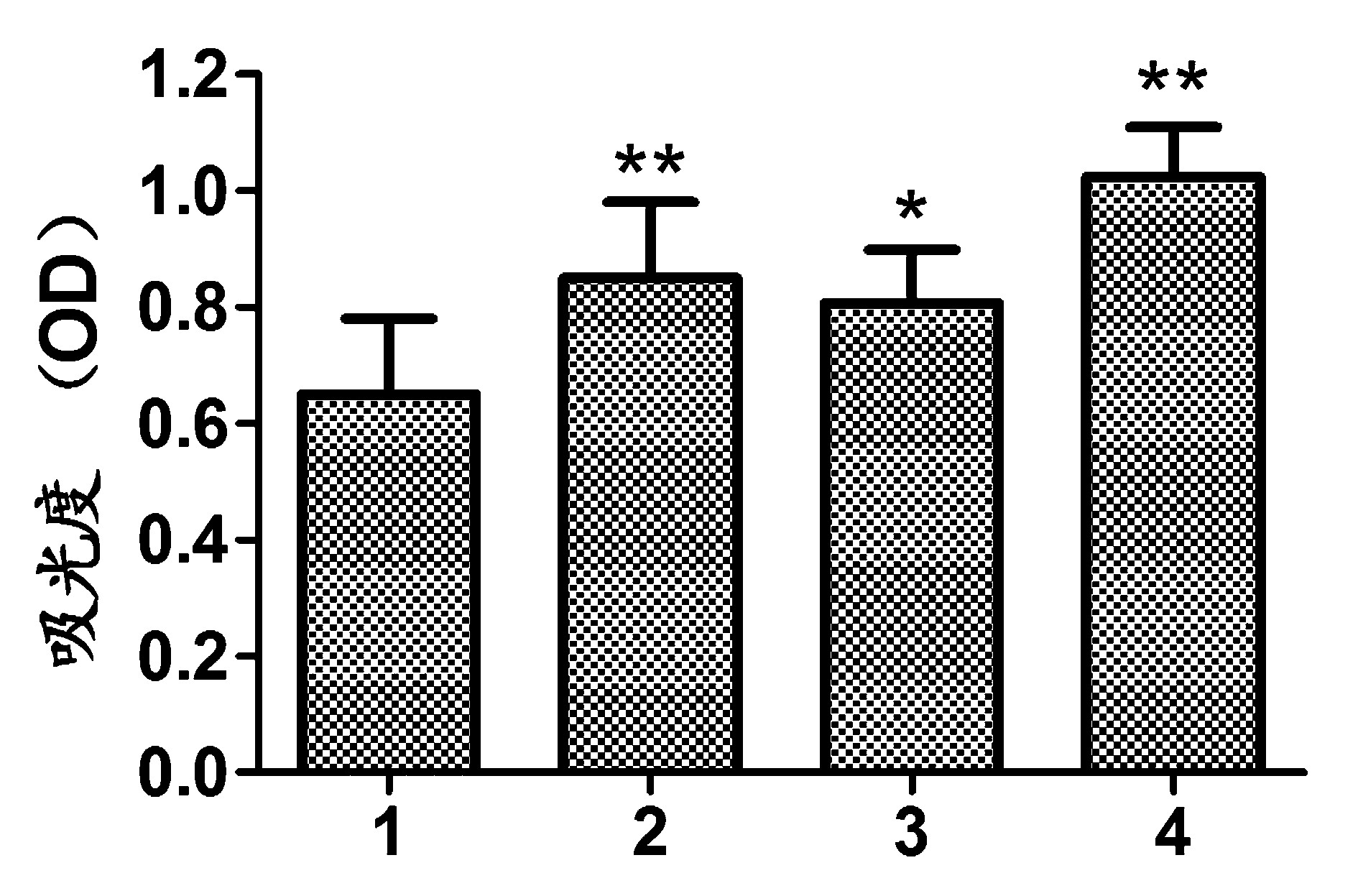
注:1:对照组;2:CCL2组;3:α-Synuclein组;4:CCL2+α-Synuclein组;* P<0.05 vs 对照组;* *P<0.01 vs 对照
组图1 小胶质细胞细胞增殖检测结果
2.2 NO含量及 TNF-α、IL-1β检测结果 取培养24 h的各组细胞培养液,检测上清液中NO含量及 TNF-α、IL-1β水平。结果发现,CCL2组、α-Synuclein组、CCL2+α-Synuclein组细胞中NO水平均明显高于对照组,差异显著(P<0.01)。CCL2组、α-Synuclein组细胞中TNF-α、IL-1β水平明显高于对照组,差异显著(P<0.05)。CCL2+α-Synuclein组细胞中TNF-α、IL-1β水平明显高于对照组,差异显著(P<0.01)。见图2。
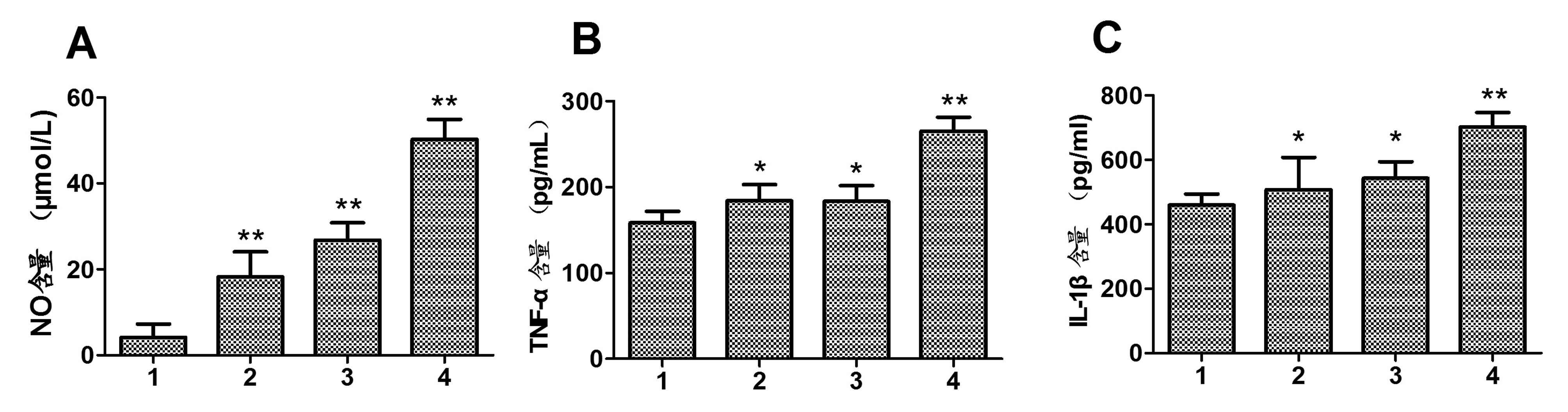
注:1:对照组;2:CCL2组;3:α-Synuclein组;4:CCL2+α-Synuclein组;A:NO含量;B:TNF-α含量;C:IL-1β含量;* P<0.05 vs 对照组;* *P<0.01 vs 对照组
图2 NO含量及 TNF-α、IL-1β检测结果
2.3 细胞中α-Synuclein水平检测结果 取培养24 h后的各组细胞,提取细胞总蛋白,Western blot检测细胞中α-Synuclein水平。结果显示,CCL2组和CCL2+α-Synuclein组细胞中α-Synuclein水平均明显高于对照组,差异显著(P<0.01)。见图3。

注:1:对照组;2:CCL2组;3:α-Synuclein组;4:CCL2+α-Synuclein组;A:Western blot结果图;B:蛋白相对表达水平;* *P<0.01 vs 对照组
图3 细胞中α-Synuclein水平检测结果
2.4 神经元凋亡检测结果 各组细胞培养24 h后,将小胶质细胞培养液加入到神经元中,流式细胞术检测24 h细胞凋亡情况,Western blot检测24 h神经元中Cleaved Caspase-3蛋白水平。结果显示,CCL2组、α-Synuclein组和CCL2+α-Synuclein组凋亡率均明显高于对照组,差异有统计学意义(P<0.01)。CCL2组、α-Synuclein组和CCL2+α-Synuclein组中Cleaved Caspase-3蛋白水平均明显高于对照组,差异有统计学意义(P<0.01)。见图4。
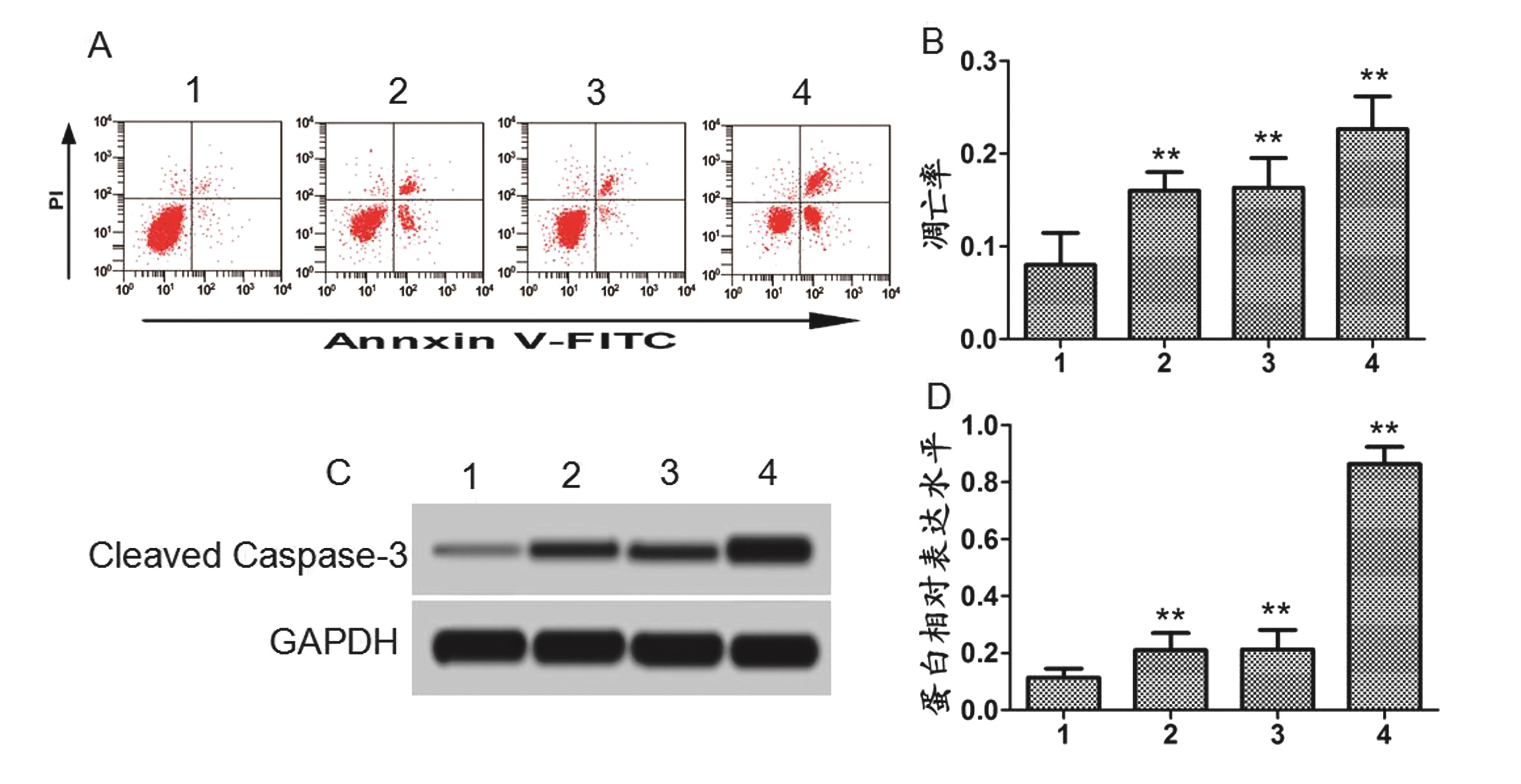
注:1:对照组;2:CCL2组;3:α-Synuclein组;4:CCL2+α-Synuclein组;A:流式细胞仪结果图;B:凋亡率;C:Western blot结果图;D:蛋白相对表达水平;* *P<0.01 vs 对照组
图4 神经元凋亡检测结果
2.5 细胞中Akt、p-Akt水平检测结果 各组细胞培养24 h后,将小胶质细胞培养液加入到神经元中,Western blot检测24 h细胞中Akt、p-Akt蛋白水平。结果显示,CCL2组、α-Synuclein组、CCL2+α-Synuclein组细胞中Akt水平与对照组相比差异无统计学意义(P>0.05)。CCL2组、α-Synuclein组和CCL2+α-Synuclein组细胞中p-Akt蛋白水平均明显低于对照组,差异有统计学意义(P<0.01)。见图5。
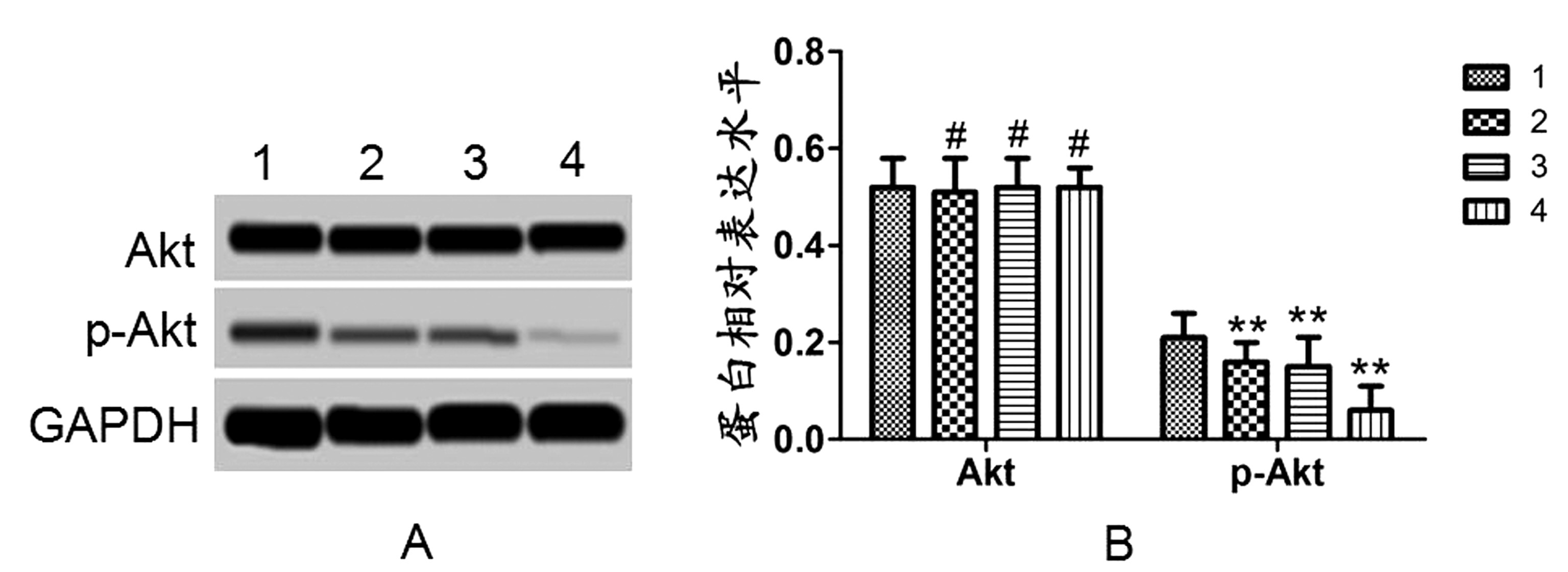
注:1:对照组;2:CCL2组;3:α-Synuclein组;4:CCL2+α-Synuclein组;A:Western blot结果图;B:蛋白相对表达水平;#P>0.05 vs 对照组;* *P<0.01 vs 对照组
图5 细胞中Akt、p-Akt水平检测结果
3 讨论
小胶质细胞起源于神经外胚层,当神经中枢系统受到损害时,小胶质细胞能够吞噬清除神经系统内的有害物质[10]。在成熟的脑组织中,小胶质细胞处于静止状态,能够感受周围环境中的异常病理变化。小胶质细胞能够促进神经元的增殖,保护大脑的组织结构。小胶质细胞活化后能够分泌多种免疫因子及NO[11]。而NO一方面具有杀死病原菌的作用,另一方面对神经元具有一定的毒性作用。有研究表明[12],神经性退变相关疾病中小胶质细胞异常活化,产生炎症因子,而这些炎症因子对神经系统具有一定的毒性。
α-Synuclein基因定位于4号常染色体上,含有7个外显子[13]。α-Synuclein蛋白在脑皮层组织、神经元突触、海马区等均有广泛表达,参与正常突触间的信号传递。正常情况下,小胶质细胞能够吞噬和降解α-Synuclein蛋白[14]。当小胶质细胞异常活化时,吞噬和降解α-Synuclein蛋白的能力下降,导致α-Synuclein蛋白的大量聚集产生神经毒性[15]。有研究表明,α-Synuclein过表达的动物机体内,小胶质细胞异常活化,神经元死亡增多[16]。用α-Synuclein蛋白刺激体外培养的小胶质细胞,小胶质细胞活化增多并产生大量的炎症因子和NO[17]。本研究中,用α-Synuclein刺激小胶质细胞,结果发现,小胶质细胞增殖能力增强,细胞分泌的NO、TNF-α、IL-1β也异常增加,这与之前的报道相一致。
CCL2是一种单核细胞趋化因子。近年来的研究表明,CCL2在神经退行性相关疾病患者的外周血和脑脊液表达升高,而抑制CCL2表达的小胶质细胞活性减弱,生物机体认知功能有所恢复[18-19]。CCL2还参与中枢神经系统的炎症反应,与生物体内NO含量和氧自由基水平有关[20]。之前的研究结果表明0.05 ng/μL的CCL2能够明显促进小胶质细胞的增殖[21-22]。本研究中用0.05 ng/μL的CCL2蛋白处理小胶质细胞,结果发现,CCL2能够促进小胶质细胞的增殖,对细胞分泌NO、TNF-α、IL-1β也具有一定的促进作用。
为了进一步研究CCL2对神经元的作用,本研究通过体外培养原代神经元,并用CCL2和α-Synuclein处理后的小胶质细胞培养液培养原代神经元,结果发现,CCL2和α-Synuclein刺激后的小胶质细胞培养液都能够促进神经元凋亡。而CCL2和α-Synuclein共同作用后的神经元凋亡更多。进一步检测神经元中促凋亡蛋白Cleaved Caspase-3和Akt信号通路相关蛋白表达水平,结果发现Cleaved Caspase-3蛋白增多,而磷酸化的Akt减弱,这提示,CCL2促进α-Synuclein诱导的小胶质细胞增殖导致的神经元凋亡增多与可能与Akt信号通路有关。
CCL2能够促进α-Synuclein诱导的小胶质细胞的增殖,促进小胶质细胞分泌炎症因子和NO,从而诱导神经元的凋亡,促凋亡作用机制可能与Akt信号通路有关。这为进一步研究神经退行性疾病的发病机制奠定了基础。
4 参考文献
[1] Glebov K,Lochner M,Jabs R,et al.Serotonin stimulates secretion of exosomes from microglia cells[J].Glia,2015,63(4):626-634.
[2] Wang Y,Gao H,Zhang W,et al.Thymoquinone inhibits lipopolysaccharide-induced inflammatory mediators in BV2 microglial cells[J].International immunopharmacology,2015,26(1):169-173.
[3] Kim M,Choi SY,Lee P,et al.Neochlorogenic acid inhibits lipopolysaccharide-induced activation and pro-inflammatory responses in BV2 microglial cells[J].Neurochemical research,2015,40(9):1 792-1 798.
[4] Chun E,Lavoie S,Michaud M,et al.CCL2 promotes colorectal carcinogenesis by enhancing polymorphonucle-ar myeloid-derived suppressor cell population and function[J].Cell reports,2015,12(2):244-257.
[5] Tsaur I,Rutz J,Makarevi J,et al.CCL2 promotes integrin-mediated adhesion of prostate cancer cells in vitro[J].World journal of urology,2015,33(7):1 051-1 056.
[6] Mbefo MK,Fares MB,Paleologou K,et al.Parkinson disease mutant E46K enhances α-synuclein phosphorylation in mammalian cell lines,in yeast,and in vivo[J].Journal of Biological Chemistry,2015,290(15):9 412-9 427.
[7] Moree B,Yin G,Lázaro DF,et al.Small molecules detected by second-harmonic generation modulate the conformation of monomeric α-synuclein and reduce its aggregation in cells[J].Journal of Biological Chemistry,2015,290(46):27 582-27 593.
[8] Kempuraj D,Thangavel R,Yang E,et al.Dopaminergic Toxin 1-Methyl-4-Phenylpyridinium,Proteins α-Synuclein and Glia Maturation Factor Activate Mast Cells and Release Inflammatory Mediators[J].PloS one,2015,10(8):e0135776.
[9] 唐志文.PHEV 感染对小胶质细胞的激活及其分泌炎症因子的影响研究[D].吉林大学,2015.
[10] 张亚琼,徐海月,刘华.小胶质细胞在年龄相关性黄斑变性中的作用机制[J].中国老年学杂志,2016,36(12):3 074-3 076.
[11] Mangino G,Famiglietti M,Capone C,et al.HIV-1 Myristoylated Nef Treatment of Murine Microglial Cells Activates Inducible Nitric Oxide Synthase,NO 2 Production and Neurotoxic Activity[J].PloS one,2015,10(6):e0130189.
[12] Cox DJ,Field RH,Williams DG,et al.DNA sensors are expressed in astrocytes and microglia in vitro and are upregulated during gliosis in neurodegenerative disease[J].Glia,2015,63(5):812-825.
[13] Vander Perren A,Macchi F,Toelen J,et al.FK506 reduces neuroinflammation and dopaminergic neurodegeneration in an α-synuclein-based rat model for Parkinson's disease[J].Neurobiology of aging,2015,36(3):1 559-1 568.
[14] Tang Y,Le W.Differential roles of M1 and M2 mi-croglia in neurodegenerative diseases[J].Molecular neurobiology,2016,53(2):1 181-1 194.
[15] Harms AS,Cao S,Rowse AL,et al.MHCII is required for α-synuclein-induced activation of microglia,CD4 T cell proliferation,and dopaminergic neurodegeneration[J].The Journal of Neuroscience,2013,33(23):9 592-9 600.
[16] Daher JPL,Volpicelli-Daley LA,Blackburn JP,et al.Abrogation of α-synuclein-mediated dopaminergic neurodegeneration in LRRK2-deficient rats[J].Proceedings of the National Academy of Sciences,2014,111(25):9 289-9 294.
[17] Codolo G,Plotegher N,Pozzobon T,et al.Triggering of Inflammasome by Aggregated α-Synuclein,an Inflammatory Response in Synucleinopathies[J].PloS one,2013,8(1):e55375.
[18] Kim RY,Hoffman AS,Itoh N,et al.Astrocyte CCL2 sustains immune cell infiltration in chronic experimental autoimmune encephalomyelitis[J].Journal of neuroimmunology,2014,274(1):53-61.
[19] Kempuraj D,Thangavel R,Fattal R,et al.Mast Cells Release Chemokine CCL2 in Response to Parkinsonian Toxin 1-Methyl-4-Phenyl-Pyridinium (MPP+)[J].Neurochemical research,2016,41(5):1 042-1 049.
[20] Bose S,Cho J.Role of chemokine CCL2 and its receptor CCR2 in neurodegenerative diseases[J].Archives of pharmacal research,2013,36(9):1 039-1 050.
[21] Gómez-Nicola D,Schetters STT,Hugh Perry V.Differential role of CCR2 in the dynamics of microglia and perivascular macrophages during prion disease[J].Glia,2014,62(7):1 041-1 052.
[22] Zhang Z,Liu J,Fan C,et al.The GluN1/GluN2B NMDA receptor and metabotropic glutamate receptor 1 negative allosteric modulator has enhanced neuroprotection in a rat subarachnoid hemorrhage model[J].Experimental neurology,2017,301(Pt A):13-25.
(收稿2017-03-17)
本文编辑:王喜梅
引用信息:张黎军,赵盼盼,赵建华,等.趋化因子CC配基2对α-Synuclein诱导的小胶质细胞增殖及神经元凋亡的影响研究[J].中国实用神经疾病杂志,2017,20(24):7-12.