神经生长因子基因修饰骨髓间充质干细胞移植治疗脑梗死大鼠的实验研究
李 光1) 邱茜茜1) 贺迎坤2) 范波胜1)△
1)焦作煤业集团中央医院神经内科,河南 焦作 454000 2) 河南省人民医院神经介入科,河南 郑州 450003
基金项目:国家自然科学基金(81601583)
△通信作者:范波胜(1973—),男,博士,主任医师,神经科副主任。研究方向:脑血管病诊治。Email:fffbbb973@163.com
作者简介:李光(1973—),男,本科,副主任医师,神经科副主任。研究方向:脑血管病诊治。
【摘要】 目的 观察神经生长因子基因(NGF)修饰的骨髓间充质干细胞(BMSCs)移植治疗脑梗死的作用及可能机制。方法 采用线栓法制备大鼠脑梗死模型,将符合条件的30只脑梗死模型大鼠按随机数字表法分为模型组(n=10),BMSCs移植组(n=10)和NGF-BMSCs移植组(n=10),分别经尾静脉注射PBS、BrdU标记的BMSCs和NGF-BMSCs各1 mL。分别于术后1 d、7 d和14 d采用改良神经功能损害评分(mNSS)对各组大鼠进行神经功能评估,于术后14 d应用HE染色观察脑组织病理情况,应用免疫荧光组织化学检测BrdU标记的移植细胞存活状况和TUNEL法检测脑组织中细胞凋亡情况。结果 NGF-BMSCs组和BMSCs组mNSS评分和TUNEL阳性细胞数较Model组减低(P<0.05),且NGF-BMSCs组较BMSCs组更低(P<0.05);HE染色显示NGF-BMSCs组和BMSCs组较Model组脑组织损伤及细胞丢失较轻,NGF-BMSCs组更明显;并且NGF-BMSCs组中的BrdU阳性细胞数较BMSCs组增多(P<0.05)。结论 NGF基因修饰的BMSCs移植较单纯BMSCs移植能进一步改善脑梗死大鼠的神经功能,其机制为能够促进植入的BMSCs在脑内存活和减轻神经细胞凋亡。
【关键词】神经生长因子;骨髓间充质干细胞;基因修饰;干细胞移植;脑梗死;大鼠
【中图分类号】 R-332 【文献标识码】 A 【文章编号】1673-5110(2018)07-0702-05 DOI:10.12083/SYSJ.2018.07.177
Therapeutic benefit of intravenous transplantation of NGF gene-modified BMSCs after cerebral infarction in rats
LI Guang1),QIU Xixi2),HE Yingkun1),FAN Bosheng1)
1) Department of Neurology,the Central Hospital of Jiaozuo Coal Group,Jiaozuo 454150,China;2) Department of Interventional Neurology,People's Hospital of Henan,Zhengzhou 450003,China
【Abstract】 Objective To investigate the role of nerve growth factor (NGF) gene-modified bone marrow mesenchymal stem cells (BMSCs) in treatment of acute cerebral infarction and its underlying mechanism.Methods Focal cerebral infarction rat models were established by middle cerebral artery suture occlution (MCAO) method.Thirty rats with cerebral infarction were randomly divided into model group,BMSCs group and NGF-BMSCs group(n=10),1ml PBS,BMSCs and NGF gene-modified BMSCs labeled with 5-bromodeoxy-uridine (BrdU) were injected respectively through tail vein on 24h after MCAO.Modified neurological severity scale (mNSS) was performed 1,7 and 14d after MCAO;14d after transplantation,pathologic morphous of brain issue after infarction was survey through HE staining;Brdu and terminal deoxynucletide transferase-mediated dUTP nick end-labeling (TUNEL) immunoflurescene labeling technique was used respectively to measure the number of BrdU positive cells and apoptosis of cells.Results The mNSS score and the number of TUNEL positive cell in BMSCs group and NGF-BMSCs group were lower than those of model group (P<0.05).To compare with BMSCs group,those indexes of NGF-BMSCs group were more lower (P<0.05).The number of BrdU positive cells in NGF-BMSCs group was more than that of MSCs group (P<0.05).HE stain showed that the brain tissue damage was milder,the number of lost cell was fewer in NGF-BMSCs group and BMSCs group than that of model group.Conclusion These findings indicate that NGF gene modified BMSCs can further improve neurological functions of rats with cerebral infarction compared with BMSCs transplantation,whose mechanism might be associated with that NGF gene modified BMSCs can reduce apoptosis of cells,protect neural cells and promote itself survival in ischemia environment.
【Key words】 Nerve growth factor;Bone marrow mesenchymal stem cells;Gene modification;Stem cell transplantation;Cerebral infarction;Rat
神经生长因子(nerve growth factor,NGF)是重要的神经营养因子之一,能促进缺血损伤的神经细胞存活、生长[1-2],对脑缺血有重要的神经保护作用[3],能够有效改善脑梗死患者的预后[4-5]。骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)是一种存在于骨髓组织中的非造血干细胞,是继胚胎干细胞和神经干细胞之后,又一种在体内外均能向神经细胞分化的干细胞[6],并且经相关实验[7-8]证实BMSCs还容易通过基因转染技术导入外源性基因,并可以在体内长期稳定表达,从而成为神经系统疾病进行基因治疗的理想靶细胞[9]。在本研究中,我们将应用NGF基因修饰的BMSCs经脑梗死模型大鼠的尾静脉移植进入其体内,以求发挥NGF和BMSCs两者的协同治疗作用,为临床治疗脑梗死做出有益的探索。
1 材料和方法
1.1 实验动物及材料 相同遗传背景健康成年雄性Sprague-Dawley(SD)大鼠,体质量280~320 g,由郑州大学医学院实验动物中心提供。优级胎牛血清(Hyclone),DMEM培养基(Hyclone公司),G418(Gibco公司),淋巴细胞分离液及BrdU(Sigma公司),小鼠抗BrdU单克隆抗体(SANTA CRUZ),TUNEL细胞凋亡检测试剂盒(Roche公司),Trizol试剂以及Lipofectamine2000转染试剂(Invitrogen公司),总RNA提取试剂盒、RT-PCR扩增试剂盒、凝胶回收试剂盒以及质粒提取试剂盒均购自德国QIAGEN公司。
1.2 方法
1.2.1 NGF基因修饰的BMSCs的过程及鉴定:重组真核表达质粒pIRES-NGF的构建;BMSCs的分离扩增、培养及鉴定;质粒pIRES-NGF转染BMSCs后的检测可参考本研究小组既往研究结果[10-11]。
1.2.2 脑梗死大鼠模型制备及实验分组:参考改良的包新杰[12]和麦筱莉[13]等制备大鼠脑梗死灌注模型。大鼠在术前12 h禁食,4 h禁水,腹腔注射水合氯醛麻醉,颈部正中切口,分离结扎左侧颈外动脉,用眼科剪在左侧颈总动脉剪V型小口,插入头端烧成圆钝形的专用尼龙线栓,沿颈内动脉向颅内插入线栓,进线长度18~19 mm,保留90 min后缓慢将线栓拔出至分叉处,实现大脑中动脉血流再灌注,模型制作完毕。模型成功的标志为栓塞对侧肢体偏瘫,行走时向对侧转圈。将30只符合条件的脑梗死模型大鼠按随机数字表法分为3组:Model组、BMSCs移植组和NGF-BMSCs移植组,每组10只。
1.2.3 细胞移植:MCAO术后24 h,将总体积为1 mL的经BrdU标记的两类细胞(细胞密度为3×106个/mL)进行尾静脉移植,即BMSCs移植组注入BMSCs,NGF-BMSCs移植组注入NGF基因修饰的BMSCs,Model组仅给予1 mLPBS进行尾静脉注入。
1.2.4 大鼠神经功能缺损评分:各组随机抽取5只大鼠分别于移植后1 d、7 d和14 d进行mNSS评分检测神经功能缺损情况,该评分规则包括运动、感觉、平衡和反射试验四个方面,0分为正常,18分为最严重神经功能缺失,评分越高提示神经功能损害程度越重[14]。
1.2.5 标本制作:实验大鼠在细胞移植后14 d随机抽取5只麻醉处死,应用4%多聚甲醛灌注固定,断头取脑,石蜡包埋,供HE染色和免疫组织化学检查。
1.2.5.1 病理学观察:进行HE染色,显微镜下观察比较各组脑组织病理学变化,拍照。
1.2.5.2 免疫组织化学检查:根据HE染色确定梗死区域,取相邻脑组织切片进行TUNEL原位检测脑组织中神经细胞凋亡的情况,结果判定:TUNEL染色阳性细胞为细胞核内出现棕黄色颗粒,在显微镜下随机计数5个高倍视野(400倍)下阳性细胞数,取其平均数,对每1个蜡块,由5张切片获得一个平均值。
1.2.5.3 免疫荧光组织化学观察:观察经BrdU标记的植入细胞在脑梗死周边区域存活情况,结果判定:Brdu阳性细胞为细胞核呈绿色荧光,计数方法同上。
1.3 统计学分析 应用SPSS 11.0统计软件,实验所得数据均经过方差齐性检验和正态性检验,结果以均数±标准差(x±s)表示,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠mNSS神经功能评分 在移植后1 d比较3组大鼠mNSS评分无显著性差异(P>0.05);在移植后7 d和14 d观察,3组大鼠神经功能均有不同程度改善,但差异有统计学意义(P<0.05),其中NGF-BMSCs移植组mNSS改善好于BMSCs移植组,差异有统计学意义(P<0.05);BMSCs移植组mNSS改善好于Model组,差异有统计学意义(P<0.05)。见表1。
表1 3组实验大鼠各时间点mNSS评分 (x±s,n=10)
| 组别 | 移植后1 d | 移植后7 d | 移植后14 d |
| Model组 | 11.25±1.14 | 8.80±0.89 | 6.95±1.01 |
| BMSCs移植组 | 11.10±1.05a | 6.80±0.86a | 5.00±0.88a |
| NGF-BMSCs移植组 | 11.05±0.90ab | 5.05±0.91ab | 3.70±0.54ab |
注:与 Model组比较,aP<0.05;与BMSCs移植组比较,bP<0.05
2.2 3组大鼠脑组织病理学比较结果 移植后14 d,3组脑组织切片HE染色显示:均可见梗死区域神经元缺失,脑组织破坏、溶解,形成坏死空腔,梗死周边区域可见细胞核固缩、裂解,胶质细胞增生,也可见微血管增生,但是在BMSCs移植组,尤其是NGF-BMSCs移植组神经细胞的损伤及丢失相对较轻,并且胶质细胞增生较少,微血管增生明显,缺血性病理改变减轻。见图1。
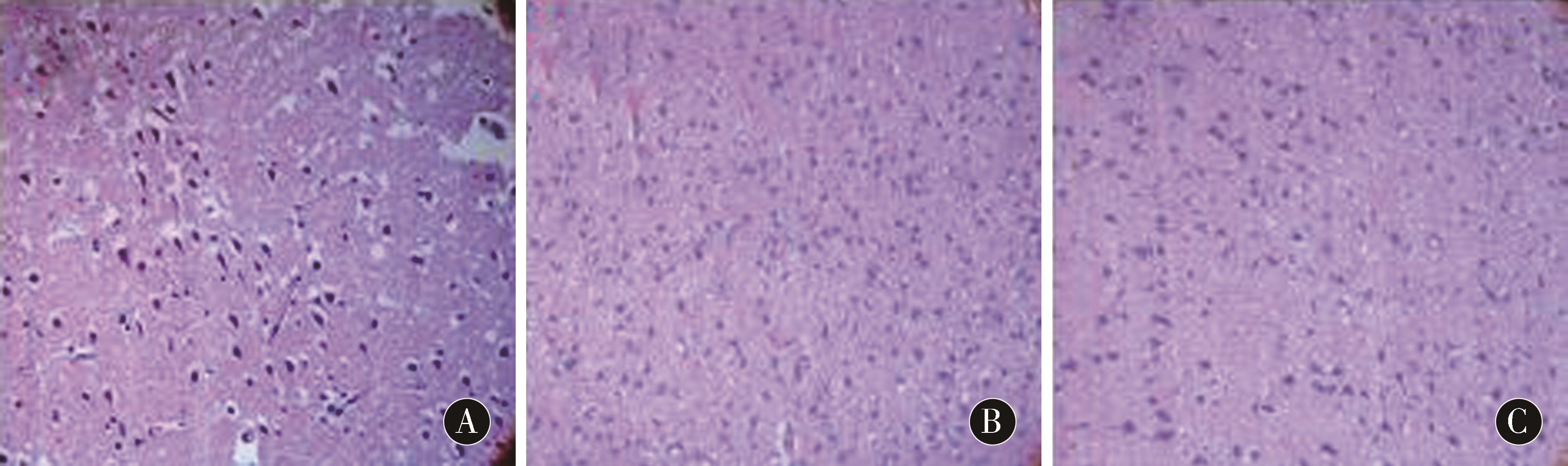
图1 3组大鼠细胞移植后14 d脑组织HE染色(×200) A:Model组;B:BMSCs组;C:NGF-BMSCs组
2.3 BrdU免疫荧光组化检测植入细胞的存活状况 在移植后14 d,移植细胞的2组均可观察到Brdu标记的阳性细胞,为细胞核呈绿色荧光,主要位于梗死周边区域(图2)。2组计数进行组间比较结果显示(表2),NGF-BMSCs组梗死周边阳性细胞数量最多,与BMSCs移植组相比差异有统计学意义(P<0.05)。
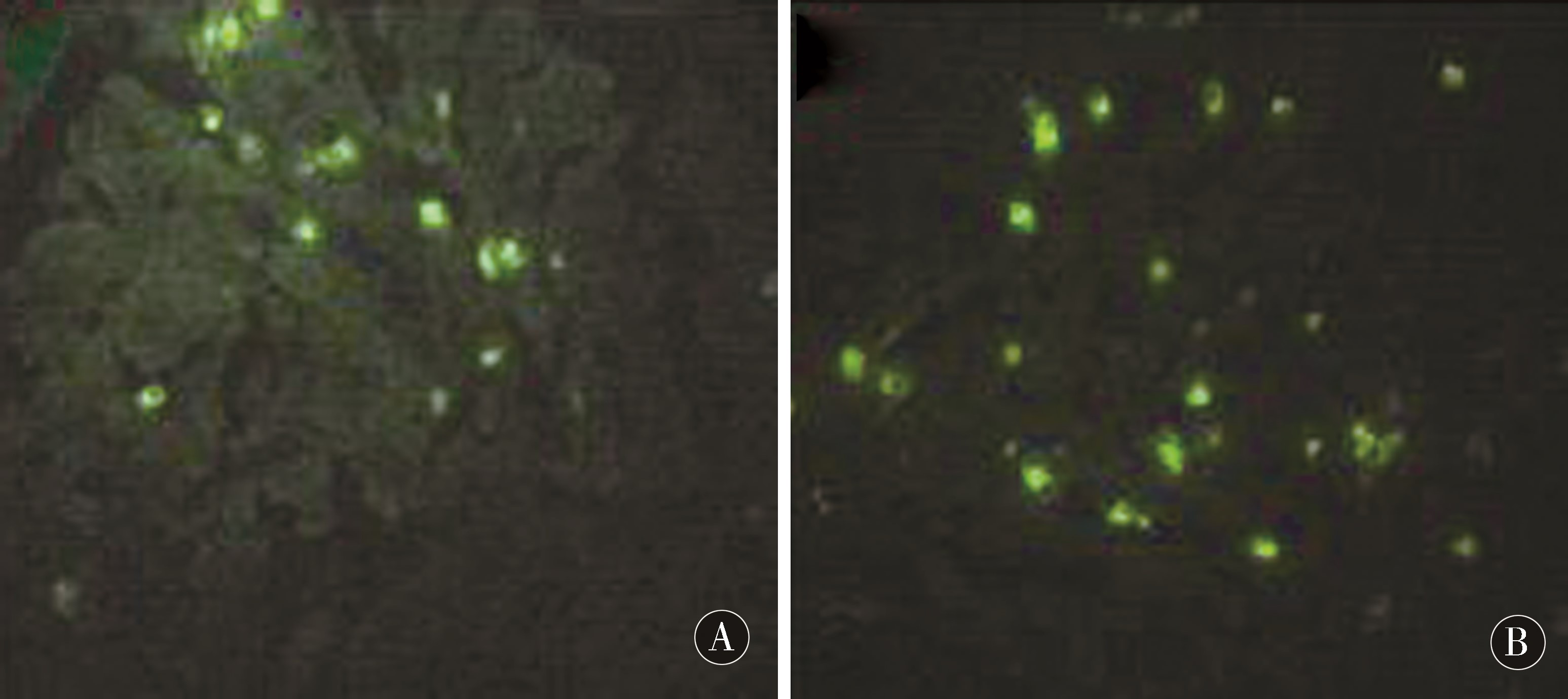
图2 2组植入细胞BrdU免疫荧光标记(×400) A:BMSCs组;B:NGF-BMSCs组
表2 各细胞移植组梗死周边Brdu阳性细胞数量 (x±s,n=5)
| 组别 | Brdu阳性细胞数 |
| BMSCs移植组 | 17.50±2.09 |
| NGF-BMSCs移植组 | 23.14±2.22 |
注:2组间比较差异有统计学意义(P<0.05)
2.4 TUNEL法原位检测细胞凋亡结果 移植后14 d,3组梗死周边区域均可见核内出现棕黄色颗粒的凋亡细胞,凋亡细胞核膜结构完整,核内染色质浓聚,染色质边集于核周(图3),计数各组凋亡细胞数目(表3)。结果显示,与Model组相比,BMSCs移植组和NGF-BMSCs移植组凋亡细胞数目明显减少,差异有统计学意义(P<0.05),同时,NGF-BMSCs移植组凋亡细胞数目又明显少于BMSCs移植组,差异有统计学意义(P<0.05)。
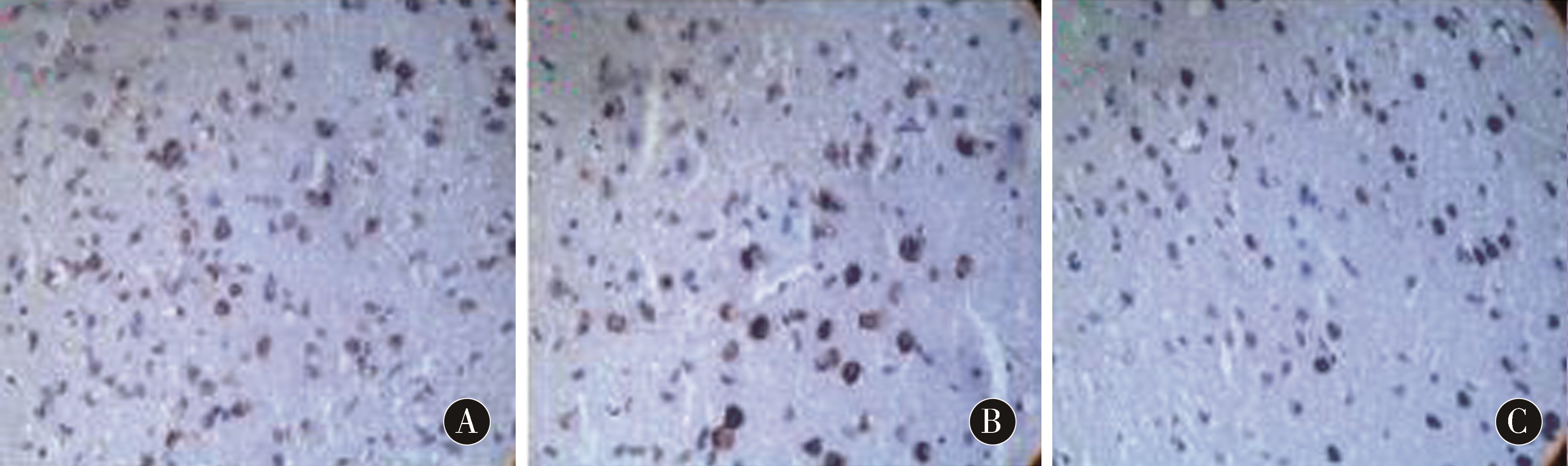
〖JZ〗图3 3组大鼠行TUNEL法原位标记凋亡细胞(×200) A:Model组;B:BMSCs组;C:NGF-BMSCs组
表3 3组凋亡细胞数目比较(×200) (x±s,n=5)
| 组别 | 凋亡细胞数目 |
| Model组 | 39.83±4.12 |
| BMSCs移植组 | 30.29±4.03 |
| NGF-BMSCs移植组 | 18.66±3.97 |
注:3组间比较差异有统计学意义(P<0.05)
3 讨论
目前,随着高血压和糖尿病等慢性疾病的发病率不断增高,脑梗死的发病率也不断提高,近年来针对急性脑梗死的治疗已取得了许多进展,尤其是急诊静脉溶栓和神经介入取栓术的广泛推广,对于在时间窗内就诊的急性脑梗死患者具有明显的治疗效果,但对于大多数错过时间窗的急性脑梗死患者的治疗仍是神经学界面临的重要难题之一,究其原因是由于脑内的神经细胞一旦发生了缺血坏死将很难修复,就会造成相应的神经功能障碍,导致患者发生较高的致残和致死率,给个人、家庭和社会带来了重大损失。
BMSCs是一种存在于骨髓组织中的非造血干细胞,属于多能干细胞[15],具有较高的端粒酶活性,能自我更新并可以在体内外分化为内、中、外3个胚层来源组织的细胞,如骨、心肌、肝、肾、神经等多种成熟细胞,是继胚胎干细胞和神经干细胞之后,又一种在体内外均能向神经细胞分化的干细胞[16]。相关实验[17-19]证实,BMSCs移植治疗脑血管病有一定的治疗效果,但是由于其在脑内存活时间较短,分化为类神经元样细胞较少,导致治疗效果有限[20]。
近年来,随着基因修饰技术的不断发展,业已证实[21]附壁生长的BMSCs通过基因转染技术易导入外源性基因,并可以在体内长期高效表达,因此BMSCs逐渐成为神经系统疾病基因治疗的理想靶细胞,可以设想将各种神经营养因子基因修饰的载体细胞移植入脑内,像“微生物泵”源源不断地分泌各种神经营养因子,发挥其生物学作用,同时还可以促进BMSCs在脑内的存活和分化。目前,研究人员利用各种神经营养因子基因修饰的BMSCs移植治疗脑部疾病[22],尤其是脑梗死已取得了较好的治疗效果[23-24],为基因治疗脑梗死提供了新的策略和途径。国内的卞合涛等[25]应用神经营养因子-3基因修饰的BMSCs移植治疗脑梗死大鼠,结果显示较单纯的BMSCs移植能够进一步降低脑梗死大鼠的mNSS评分,从而改善其神经功能障碍,并且经TCC染色证实减少了梗死体积,取得了较满意的治疗效果;还有李金艳等[26]应用促红细胞生成素修饰的BMSCs大鼠尾静脉移植治疗脑梗死,实验证实较单纯BMSCs其可促进移植的BMSCs在脑内缺血损伤的部位存活,减轻脑细胞凋亡,从而促进脑梗死大鼠的神经功能障碍得到改善。另外,宋艳玲等[27]应用携带VEGF基因的BMSCs移植入MCAO模型大鼠,发现可以促进缺血脑组织新生血管的形成和上调缺血周边区域Ang-2、CD34的表达水平,使得脑梗死大鼠的神经功能障碍也得到减轻。这些实验显示应用各种神经营养因子基因修饰的BMSCs治疗脑梗死已成为近年来研究的热点。
NGF是在1952年先由Levi-Montalcini在鼠肉瘤中发现,后来Cohen又从鼠颌下腺中纯化了NGF,它的发现和研究开拓了神经科学一个崭新的研究领域,由此这两位科学家被授予了1986年诺贝尔医学奖[28]。NGF是神经营养因子家族中的重要成员之一,是促进神经细胞生长和修复必需的活性物质之一,并且在神经系统、免疫系统和内分泌等系统的相互关系中发挥着重要的调节作用[29],还可以促进神经干细胞向神经元的分化[30]。
在本研究中,我们设计应用NGF基因修饰的BMSCs通过大鼠尾静脉移植进入MCAO模型大鼠体内,结果表明NGF-BMSCs组较单纯BMSCs组的mNSS评分进一步下降(P<0.05),促进了脑梗死模型大鼠的神经功能障碍的恢复,并且经病理组织切片证实NGF-BMSCs组较单纯BMSCs组脑组织损伤及细胞丢失减轻,通过免疫荧光组织化学还证实NGF基因修饰的BMSCs能够促进植入的BMSCs在脑内存活和减轻细胞凋亡,取得了较满意的治疗效果,为基因治疗脑梗死做出了有益的探索。
4 参考文献
[1] 孙迪迪.鼠神经生长因子治疗脑梗死临床分析[J].中国实用神经疾病杂志,2016,19(18):119-120.
[2] 谢九冰,杨杉杉,刘若屏,等.神经生长因子对原发性闭角型青光眼的视神经保护作用[J].广东医学,2017,38 (21):3 266-3 269.
[3] 李扬,陈晓迪,李爱丽.神经生长因子与脑梗死的相关性分析[J].中国实验诊断学,2016,20(10):1 792-1 79;1 795.
[4] 姜忠梅,卢冬喜,李红霞.鼠神经生长因子辅助治疗急性脑梗死疗效观察[J].山东医药,2015,55(34):106-107.
[5] 黄彦泽,许敬奇.神经生长因子对脑梗死偏瘫患者神经及运动功能的作用[J].广东医学,2016,37(z1):235-236.
[6] 张广宇,贾延劼,王军,等.氯化锂通过调节自噬通路促进大鼠骨髓间充质干细胞向神经细胞分化[J].中国病理生理杂志,2017,33(12):2 128-2 133.
[7] 朱敏,徐运,张跃,等.慢病毒介导的EphrinB2 基因转染大鼠骨髓间充质干细胞表达的实验研究[J].中风与神经疾病杂志,2017,34(6):508-511.
[8] 李雅婧,诸葛福艳,梁娟,等.表达hCD4和hCCR5基因的骨髓间充质干细胞模型的建立[J].重庆医学,2017,46(32):4 465-4 468;4 472.
[9] 孙立国,李宏国,范宏斌.骨髓间充质干细胞基因转染应用的研究进展[J].中国矫形外科杂志,2014,22(1):36-39.
[10] 范波胜,娄季宇,白宏英.重组双基因表达质粒pIRES-NGF-VEGF165转染大鼠BMSCs及表达鉴定[J].中风与神经疾病杂志,2012,29(12):1 077-1 079.
[11] 范波胜,娄季宇,白宏英.神经生长因子与血管内皮生长因子165双基因共表达载体的构建及鉴定[J].中华老年心脑血管病杂志,2013,15(4):427-429.
[12] 包新杰,李雪元,左赋兴,等.稳定的大鼠大脑中动脉栓塞脑梗死模型的建立[J].中国实验动物学报,2016,24 (4):395-398.
[13] 麦筱莉,韩冰,范海健,等.小鼠缺血性脑梗死模型的制作及7TMR成像的实验研究[J].医学影像学杂志,2012,22(10):1 755-1 758.
[14] 孙晶晶,宋乃光,张耀龙,等.人端粒酶反转录酶基因修饰骨髓间充质干细胞移植治疗脑梗死[J].中国组织工程研究,2015,19(41):6 665-6 670.
[15] DELORME B,CHATEAUVIEUX S,CHARBORD P.The concept of esenchymalstem cells[J].Regen Med,2006,1(4):497-509.
[16] 杜佳蕾,张曦元,万娜,等.体外诱导大鼠骨髓间充质干细胞向神经干细胞分化的研究进展[J].中西医结合心血管病杂志(电子版),2017,5(27):32-33.
[17] 张晓英,曲志玲.干细胞移植治疗脑血管病的临床研究[J].中国实用神经疾病杂志,2008,11(1):56-57.
[18] 程率芳.骨髓间充质干细胞移植脑梗死大鼠:神经功能恢复与突触素的表达[J].中国组织工程研究,2016,20 (28):4 182-4 188.
[19] 黄爱华,张萍萍,张斌,等.人胚胎骨髓间充质干细胞和单个核细胞静脉移植治疗大鼠脑梗死疗效的比较[J].中国医学科学院学报,2016,38(5):497-506.
[20] 赵仁超,顾建娟,黄敏,等.骨髓间充质干细胞静脉移植治疗大鼠脑梗死的机制研究[J].神经疾病与精神卫生,2016,16(6):654-658;封3页.
[21] CHEN X,LIN X,ZHAO J,et al.A tumor-selective biotherapy with prolonged impact on established metastases based on cytokine gene-engineered MSCs[J].Mol Ther,2008,16(4):749-756.
[22] 许玲,邢衢,马珊珊,等.HDAC1基因沉默的hUC-MSCs移植对创伤性脑损伤小鼠的神经保护作用[J].郑州大学学报(医学版),2017,52(6):697-701.
[23] 刘凯,姜云霞,邓文帅,等.血管生成素-1基因修饰的骨髓间充质干细胞移植对脑梗死大鼠行为学的影响[J].山东医药,2015,55(40):4-7.
[24] 周国庆,金怡,张鹏.沉默RhoA基因对骨髓间充质干细胞静脉移植治疗脑梗死大鼠的作用[J].中国组织工程研究与临床康复,2010,14(45):8 416-8 420.
[25] 卞合涛,郝楼,黄卫.NT-3基因修饰骨髓间充质干细胞移植治疗脑梗死及其机制研究[J].中华神经医学杂志,2017,16(9):906-910.
[26] 李金艳,王亮.促红细胞生成素基因修饰骨髓间充质干细胞移植治疗大鼠脑梗死[J].中国组织工程研究,2014,18(23):3 664-3 669.
[27] 宋艳玲,赖天宝,李嫚.VEGF基因修饰MSCs移植对脑梗死大鼠血管源性机制的实验研究[J].卒中与神经疾病,2011,18(6):323-325.
[28] 郭晓强,向晋涛.蒙塔尔奇尼:神经生长因子的发现者[J].中国心脏起搏与心电生理杂志,2014,28(2):177.
[29] 赵英华,刘晓昌,高乐,等.神经生长因子修饰的间充质干细胞促进兔下颌骨牵张成骨时下牙槽神经损伤修复的实验研究[J].创伤外科杂志,2016,18(3):168-171.
[30] 苏立宁,宋小青,魏会平,等.神经生长因子诱导大鼠骨髓间充质干细胞向神经细胞分化的效果观察及相关蛋白网络分析[J].山东医药,2016,56(39):33-35.
(收稿2018-01-10 修回2018-02-11)
本文编辑:王喜梅
本文引用信息:李光,邱茜茜,贺迎坤,范波胜.神经生长因子基因修饰骨髓间充质干细胞移植治疗脑梗死大鼠的实验研究[J].中国实用神经疾病杂志,2018,21(7):702-706.